微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述的原因不是由于原电池造成的是
A.运输液氯的铁管被腐蚀
B.金属在潮湿空气中更容易腐蚀
C.铁与酸反应滴加硫酸铜后反应加快
D.含杂质的锌比纯锌与酸反应快
参考答案:A
本题解析:
试题分析:氯气与铁反应生成三氯化铁,属于化学腐蚀,A项符合;金属在潮湿的空气中容易形成原电池而加快腐蚀,B项不符;铁与硫酸铜反应生成铜,铁-铜-酸形成原电池,化学反应速率加快,C项不符;锌-杂质-酸构成原电池,反应速率加快,D不符;选A。
考点:考查原电池的工作原理。
本题难度:一般
2、填空题 理论上讲,任何自发的氧化还原反应都可以设计成原电池.请你利用下列反应“Cu+2Ag+=2Ag+Cu2+”设制一个化学电池,并回答下列问题:
①该电池的正极材料是______,负极材料是______,电解质溶液是______.
②在外电路中,电流方向是从______极到______极.
③正极上出现的现象是______.负极上出现的现象是______.
参考答案:①根据电池总反应可知,在反应中,Cu被氧化,失电子,应为原电
本题解析:
本题难度:一般
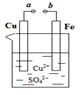
3、选择题 某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
 [???? ]
[???? ]
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=?Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b用导线连接时,SO42-向铜电极移动
参考答案:D
本题解析:
本题难度:一般
4、填空题 (20分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。(1) 在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2) 已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g) 的焓变ΔH=_____________。
(3) 高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g)? ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g)? ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
① 温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
② 1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应是否处于化学平衡状态____________(填“是”或“否”),其判断依据是______
____________________________________________________________。
(4) 如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
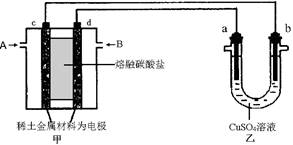
① 甲装置中气体A为????????(填“CH4”或“O2和CO2”),d极上的电极反应式为
_____________________________________。
② 乙装置中a极上的电极反应式为__________________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③ 如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为__________________________(用含w、a的表达式表示,不必化简)。
参考答案:(1) CH4(g)+2O2(g)=CO2(g)+2H2O(
本题解析:本题为化学反应与能量综合考查题。(1)为热化学方程式的书写,需要注意问题有反应与计量系数的对应关系,物质状态,吸热与放热等,可以写出CH4(g)+2O2(g)=CO2(g)+2H2O(l)?△H= -890.31kJ·mol-1??;(2)考查盖斯定律的应用。三个方程式依次编号为①②③,目标方程式等于①-②-③,故ΔH=-437.3-(-285.8)-(-283.0)=+131.5KJ/mol;(3)平衡常数只与温度有关,温度升高,平衡正向移动,故K增大,Q==0.25<K,故平衡平衡正向移动;(4
本题难度:一般
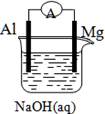
5、选择题 将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、电流计连接成原电池,此电池工作时,下列叙述中正确的是??
 ??
??
A.Mg比Al活泼,Mg 失去电子被氧化成Mg2+
B.负极反应式为:Al+4OH--3e-=AlO2-+2H2O
C.该电池的内外电路中,电流均是由电子定向移动形成的
D.Al是电池阴极,开始工作时溶液中会立即有白色沉淀析出
参考答案:B
本题解析:
试题分析:A项:原电池中,Al发生反应,Mg不反应,故错;C项:内电路中电流是由电荷的定向移动形成的,故错;D项:不会有沉淀析出,故错。故选B。
点评:本题考查的是原电池正负极的判断及电极反应式的书写。难度易。注意基础知识的学习。
本题难度:简单