微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)(1)已知N≡N、N—H、H—H的键能分别为946kJ·mol-1、390.8kJ·mol-1、436.0kJ·mol-1。试根据盖斯定律,写出合成氨反应的热化学方程式 。
(2)在通常状况下,足量氢氧化钠的稀溶液与含溶质为1mol的稀硫酸完全反应时放出akJ的热量,写出该反应中和热的热化学方程式____________。
(3)以镁和铝为电极,以NaOH作电解质溶液,构成原电池时,铝做 极,电极反应式为 ;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_______________,该电池总反应的离子方程式为_____________。
参考答案:(12分)
(1)N2(g)+3H2(g)![]()
本题解析:
试题分析:(1)化学反应的实质是破坏化学键吸收能量和形成化学键释放能量的过程,根据化学反应N2(g)+3H2(g) 2NH3,破坏化学键吸收的能量为946kJ·mol-1+3×436.0kJ·mol-1="2254" kJ·mol-1,形成化学键释放的能量为390.8kJ·mol-1×6=2344.8kJ·mol-1,则热量变化为2254 kJ·mol-1-2344.8kJ·mol-1=-90.8kJ/mol,合成氨反应的热化学方程式为N2(g)+3H2(g)
2NH3,破坏化学键吸收的能量为946kJ·mol-1+3×436.0kJ·mol-1="2254" kJ·mol-1,形成化学键释放的能量为390.8kJ·mol-1×6=2344.8kJ·mol-1,则热量变化为2254 kJ·mol-1-2344.8kJ·mol-1=-90.8kJ/mol,合成氨反应的热化学方程式为N2(g)+3H2(g) 2NH3 (g) △H =-90.8kJ/mol。
2NH3 (g) △H =-90.8kJ/mol。
(2)中和热是指强酸强碱的稀溶液反应生成1mol水时放出的热量,1mol的稀硫酸完全反应时放出akJ的热量,则生成1mol水时放出的热量为a/2,该反应中和热的热化学方程式为NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+ H2O(l) △H=-a/2kJ/mol。
(3)镁和铝为电极,以NaOH作电解质溶液构成的原电池,铝与氢氧化钠反应,而镁不反应,所以,铝作负极,电极反应式为Al-3e+4OH-=2H2O+AlO2-;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,则FeO42-得电子生成Fe(OH)3和OH-,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,负值是Zn失电子,在碱性溶液中生成Zn(OH)2,电极反应为Zn-2e-+2OH-=Zn(OH)2,再根据正负极转移电子数相等,配平,然后正负极相加得该电池总反应,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=2Fe(OH)3+4OH-+3Zn(OH)。
考点:考查盖斯定律的应用,中和热及原电池电极反应的书写。
本题难度:一般
2、选择题 依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s) 设计的原电池如图所示。下列叙述正确的是??????????(??)
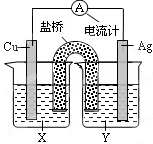
A.Y为CuSO4溶液
B.正极反应为Cu-2e- = Cu2+
C.在外电路中,电流从Cu极流向Ag极
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池
反应相同
参考答案:D
本题解析:在原电池中负极是失去电子,发生氧化反应,正极是得到电子,发生还原反应的。根据反应式可知,铜失去电子,Ag+得到电子,因此铜是负极,电解质必须含有Ag+。在原电池中电流的方向是从正极流向负极,所以正确的答案是D。
本题难度:一般
3、选择题 有关下图装置叙述正确的是
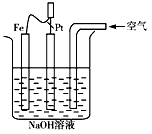 [???? ]
[???? ]
A.这是电解NaOH溶液的装置
B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色
C.Pt为正极,其电极反应为:O2+4e-+2H2O→4OH-
D.Fe为阳极,电极反应为:2Fe-4e-+4OH-→2Fe(OH)2
参考答案:CD
本题解析:
本题难度:一般
4、选择题 关于铅蓄电池的说法正确的是( )
A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-=PbSO4(s)
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq)
参考答案:A.铅蓄电池放电时,正极上PbO2得电子被还原,电极反应式为
本题解析:
本题难度:简单
5、选择题 实验室欲制氢气,所用稀盐酸和稀硫酸的浓度相同,反应速率最快的是[???? ]
A.纯锌与稀硫酸反应
B.纯锌和浓硫酸反应
C.纯锌与稀盐酸反应
D.粗锌(含铅、铜杂质)与稀硫酸反应
参考答案:D
本题解析:
本题难度:简单