微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对0.2mol·L-1碳酸钠溶液的微粒浓度分析正确的是
A.[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+]
B.[Na+]+[H+]=[CO32-]+[HCO3-]+[OH-]
C.[OH-]=[H+]+[HCO3-]+[H2CO3]
D.[CO32-]+[HCO3-]+[H2CO3]=0.2mol·L-1
参考答案:AD
本题解析:碳酸钠为强减弱酸盐,其溶液发生如下电离和水解过程:
Na2CO3====2Na++CO32-
CO32-+H2O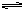 HCO3-+OH-
HCO3-+OH-
HCO3-+H2O H2CO3+OH-
H2CO3+OH-
故溶液中存在的微粒有Na+、H+、OH-、CO32-、HCO3-、H2CO3等,它们的浓度关系:[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+]。按电荷守恒分析其浓度关系:
[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]
按物料守恒分析其浓度关系:
[Na+]=[CO32-]+[HCO3-]+[H2CO3]
∵[Na+]=0.2mol·L-1,?∴[CO32-]+[HCO3-]+[H2CO3]=0.2mol·L-1。
本题难度:一般
2、选择题 下列溶液中各微粒的浓度关系正确的是
A.室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+)
B.将10 mL 0.l mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.l mol·L-1盐酸中:
c(Na+) >c(Cl-) >c(HCO3-) >c(CO32-)
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+) = c(K+) = c(Ba2+)
D.0.2 mol·L-1的某一元弱酸HA溶液和0.l mol·L-1NaOH溶液等体积混合后的溶液:
2c(OH-) + c(A-) = 2c(H+) + c(HA)
参考答案:D
本题解析:
试题分析:A.室温下,pH=7的醋酸和醋酸钠的混合溶液,根据电荷守恒可知c(CH3COO-)=c(Na+),错误;B.将10 mL 0.l mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.l mol·L-1盐酸时,由于开始时盐酸过量所以发生反应:Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑,当盐酸恰好完全反应时,再加入Na2CO3就不再发生反应,因此溶液为Na2CO3和NaCl的混合溶液,NaCl是强酸强碱盐,而Na2CO3是强碱弱酸盐,但是酸根离子CO32-水解程度是微弱的,所以离子关系为c(Na+) >c(Cl-)>c(CO32-)>c(HCO3-),错误;C.一水合氨是弱碱, KOH和Ba(OH)2是强碱,所以等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+) = c(K+) = 2c(Ba2+),错误;D.0.2 mol·L-1的某一元弱酸HA溶液和0.l mol·L-1NaOH溶液等体积混合后的溶液是NaA与HA等物质的量的混合溶液,根据物料守恒可得:c(A-) + c(HA) =2c(Na+);根据电荷守恒可得:c(OH-) + c(A-) = c(H+) + c(Na+); 两式联立整理可得2c(OH-) + c(A-) = 2c(H+) + c(HA),正确。
考点:考查微粒的浓度大小比较的知识。
本题难度:困难
3、选择题 下列溶液,阴离子总浓度最大的是( )
A.0.2 mol / L NaCl
B.0.1 mol / L Ba(OH)2
C.0.2 mol / L K2S
D.0.2 mol / L (NH4)2SO4
参考答案:C
本题解析:本题主要考查电离和水解情况;电离出来的阴离子浓度A、B、C、D分别为0.2、0.2、0.2、0.2;由于S2-水解S2-+H2O HS-+OH-;故离子数目增多,答案选C。
HS-+OH-;故离子数目增多,答案选C。
本题难度:一般
4、选择题 醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,有关0.1 mol/L醋酸钡溶液中粒子浓度比较不正确的是
A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(H+)=c(OH-)-c(CH3COOH)
D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)
参考答案:A
本题解析:
本题难度:一般
5、选择题 已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3
参考答案:
本题解析:
本题难度:困难