微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )。

参考答案:D
本题解析:等质量的两份锌粉中,加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则a中发生的反应有:Zn+Cu2+=Zn2++Cu,Zn+2H+=Zn2++H2↑,由于置换出来的Cu与Zn在稀硫酸中构成原电池,所以,a中的反应速率比b中的反应速率大,即反应完成所需的时间短,但Cu2+消耗了少量的Zn,a中产生的H2比b中产生的H2少。b中只发生反应:Zn+2H+=Zn2++H2↑。符合这些条件的图像就是D。
本题难度:一般
2、实验题 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
?
实验序号
| A溶液
| B溶液
|
①
| 20 mL 0.1 mol·L-1H2C2O4溶液
| 30 mL 0.01 mol·L-1KMnO4溶液
|
②
| 20 mL 0.2 mol·L-1
H2C2O4溶液
| 30 mL 0.01 mol·L-1KMnO4溶液


(1) 该实验探究的是??????因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是??????- ???(填实验序号)。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),
则在2 min末,c(MnO4-)=??????mol/L。
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定???????????????????????????????????????????来比较化学反应速率。
(4)小组同学发现反应速率总是如右图,其中t1~t2时间内速?率变快的主要原因可能是:①该反应放热、②???????????????????????????????????。
参考答案:(1)浓度?????? ②>①
(2)0.0052
本题解析:
试题分析:(1)从题中可以看出H2C2O4溶液的浓度不同,KMnO4溶液而的浓度相同,说明该实验探究的是浓度对对化学反应速率的影响,并且浓度越大,反应速率越快,相同时间内针筒中所得CO2的体积为②>①;(2)中,在2 min末收集了4.48 mL CO2(标准状况下),即得到了0.0002mol CO2,根据2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知,消耗了0.00004mol MnO4-,则剩下的
(30*0.010/1000)-0.00004=0.000
本题难度:一般
3、填空题 (16分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g)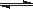 Si3N4(s)+6CO(g) Si3N4(s)+6CO(g)
(1)已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的?H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是 。
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是 。
A.升高温度 B.降低压
C.加入更多的SiO2 D.充入N2
某温度下,测得该反应中N2和CO各个时刻的浓度如下,
时间/min
| 0
| 5
| 10
| 15
| 20
| 25
| 30
| 35
| 40
| 45
| N2浓度/mol·L-1[
| 4.00
| 3.70
| 3.50
| 3.36
| 3.26
| 3.18
| 3.10
| 3.00
| 3.00
| 3.00
| CO浓度/mol·L-1
| 0.00
| 0.90
| 1.50
| 1.92
| 2.22
| 2.46
| 2.70
| —
| —
| —
求0—20 min内N2的平均反应速率V(N2 )= ,该温度下,反应的平衡常数K= 。
参考答案:(1)?H =-1591.2KJ/mol(2)ACD(3)B
本题解析:
(1)?H =132.6kJ/mol ×12=-1591.2KJ/mol(2)ACD正确,B不正确,速率比等于计量数之比(3)BD 正确,A、升温平衡向吸热的方向移动,逆向移动;C、不正确,SiO2是固体,加SiO2不能改变反应物的浓度。
(4)v(N2)="(" 4.00-3.26) mol·L-1/20mim=3.70×10-2 mol·L-1·min-1
 ,k为81.0 mol·L-1 ,k为81.0 mol·L-1
本题难度:一般
4、计算题
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g)???△H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g)????????????????????△H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=??????kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) ?△H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下: N2(g)+CO2(g) ?△H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
??????????时间(mol/L)
浓度(mol/L)
| ?0
| 10
| 20
| 30
| 40
| 50
| NO
| 1.00
| 0.68
| 0.50
| 0.50
| 0.60
| 0.60
| N2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
| CO2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
①0~10min内,NO的平均反应速率v(NO)=???????,T1℃时,该反应的平衡常数K=??????;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是??????(填字母编号)。
a.通入一定量的NO??????????? b.加入一定量的活性炭
c.加入合适的催化剂?????????? d.适当缩小容器的体积???
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q????????0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是?????(填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)?
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变????????????????
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:
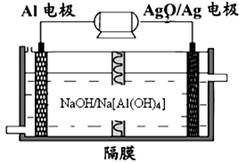 ??????????? ???????????
请写出该电池正极反应式??????????;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH=?????(不考虑溶液体积的变化)。
参考答案:(1)0.5a+b
(2)①0.032mol·L-1
本题解析:(1)根据反应①2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g)?△H=a kJ·mol-1、②3AlCl(g) =2Al(l)+AlCl3(g)?△H=b kJ·mol-1并依据盖斯定律可知,①÷2+②即得到反应 Al2O3(s)+3C(s)=2Al(l)+3CO(g),所以该反应的△H=(0.5a+b)kJ/mol。
(2)①根据表中数据可知0~10min内,NO的平均反应速率v(NO)=(1.0mol/L-0.68mol/)10min=0.032mol?L-1
本题难度:一般
5、选择题 下列有关化学反应速率的说法正确的是
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速度减小
C.SO2的催化氧化是一个放热的反应,所以升高温度,V逆加快,V正减慢
D.对于CaCO3+2HCl===CaCl2+H2O+CO2↑不能用CaCO3的浓度变化来表示反应速率,但可用水的浓度变化来表示
参考答案:B
本题解析:
试题解析:铁在常温下遇浓硫酸“钝化”,A项错误;加入NaCl溶液,溶液的体积增大,盐酸的物质的量浓度减小,反应速率减慢,B项正确;升高温度,正逆化学反应速率都加快,C项错误;D、固体和纯液体不能表示化学反应速率,水是纯液体,也不能表示反应速率,D项错误。
考点:化学反应速率
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772