微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列混合溶液中,各离子浓度的大小顺序正确的是 ( )
A.10 mL 0.1 mol·L-1氨水与10 mL 0.1 mol·L-1盐酸混合,
c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.10 mL 0.1 mol·L-1NH4Cl溶液与5 mL 0.2 mol·L-1NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10 mL 0.1 mol·L-1CH3COOH溶液与5 mL 0.2 mol·L-1NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10 mL 0.5 mol·L-1NaOH溶液与6 mL 1 mol·L-1盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
参考答案:B
本题解析:A、恰好中和生成NH4Cl,水解呈酸性,故有c(H+)>c(OH-);
B、恰好反应生成NH3·H2O,只考虑其电离呈碱性;
C、恰好反应生成CH3COONa,CH3COO-水解呈碱性,故Na+)>c(CH3COO-);
D、中和后,盐酸过量,c(H+)>c(OH-);
本题难度:一般
2、填空题 已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为(填序号) 。
(2)若四种离子的关系符合③,则溶质为 ;若四种离子的关系符合④,则溶质为 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是(填选项) 。

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+) c(OH-)。
参考答案:(1)NH4Cl ①
(2)NH4Cl和NH3·H2O
本题解析:本题考查盐类水解、电离平衡知识。(1)由已知的四种离子,当溶液中只存在一种溶质时,为NH4Cl;NH4Cl为强酸弱碱盐,水解呈酸性,离子浓度关系为①。(2)四种离子的关系符合③时,溶液呈碱性,说明碱过量,则溶液中存在的溶质为NH4Cl和NH3·H2O;当四种离子的关系符合④时,溶液呈强酸性,盐酸过量,溶液中存在NH4Cl和HCl。(3)NH4Cl为强酸弱碱盐,稀释促进其水解,盐酸为强酸,在溶液中全部电离,pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,盐酸的pH大于NH4Cl,B项符合。(4)体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则原溶液中NH3·H2O浓度大于盐酸的浓度,由于HCl是强电解质,在溶液中完全电离,故混合前盐酸中的c(H+)大于氨水中的c(OH-)。
本题难度:困难
3、选择题 向体积Va的0.05 mol·L-1 CH3COOH溶液中加入体积为Vb的0.05 mol·L-1 KOH溶液,下列关系错误的是
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
参考答案:C
本题解析:
试题分析:A、Va>Vb时,反应后的溶质CH3COOH、CH3COOK,n(CH3COOH)>n(KOH),根据物料守恒,c(CH3COOH)+c(CH3COO-)>c(K+),正确;B、Va=Vb时,反应后的溶质CH3COOK,根据质子守恒,c(CH3COOH)+c(H+)=c(OH-),正确;C、Va<Vb时,反应后的溶质是KOH、CH3COOK,因此离子浓度大小顺序:c(K+)>c(CH3COO-)>c(OH-)>c(H+)或者:c(K+)>c(OH-)>c(CH3COO-)>c(H+),错误;D、根据溶液呈现电中性:溶液中阳离子是K+、H+,阴离子是OH-、CH3COO-,因此c(K+)+c(H+)=c(OH-)+c(CH3COO-),正确。
考点:考查离子浓度大小的比较。
本题难度:一般
4、选择题 莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,下列有关该盐溶液的比较,不正确的是( )
A.c(SO )>c(NH
)>c(NH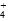 )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
B.c(SO )=c(NH
)=c(NH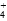 )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
C.2c(SO )+c(OH-)=c(NH
)+c(OH-)=c(NH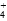 )+2c(Fe2+)+c(H+)
)+2c(Fe2+)+c(H+)
D.c(NH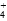 )+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2]
)+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2]
参考答案:B
本题解析:(NH4)2Fe(SO4)2完全电离,方程式为(NH4)2Fe(SO4)2=2NH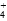 +Fe2++2SO
+Fe2++2SO ,因NH
,因NH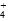 、Fe2+水解,则c(NH
、Fe2+水解,则c(NH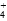 )、c(Fe2+)略减小,A对、B错;据电荷守恒知:2c(SO
)、c(Fe2+)略减小,A对、B错;据电荷守恒知:2c(SO )+
)+
c(OH-)=c(NH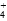 )+2c(Fe2+)+c(H+),C对;据原子守恒知:c(NH
)+2c(Fe2+)+c(H+),C对;据原子守恒知:c(NH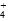 )+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2],D对。
)+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2],D对。
本题难度:一般
5、选择题 下列物质溶于水,由于水解而使溶液呈酸性的是( )
A.P2O5
B.NaHSO4
C.NaF
D.CuCl2
参考答案:D
本题解析:略
本题难度:一般