微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是:( )
A.c(NH4+)>c(Cl
参考答案:
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
参考答案:D
本题解析:略
本题难度:一般
3、填空题 (18分)研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义。
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为________________,所得溶液中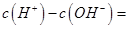 _________ (填字母编号)。
_________ (填字母编号)。
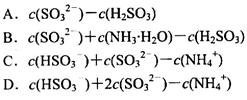
(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物。
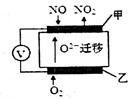
①乙电极上发生的是_________反应(填“氧化”或“还原”);
②甲电极上的电极反应式为___________________。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)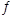 CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:
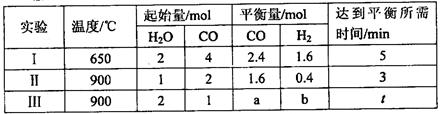
①由表中数据可知该反应的△H________ 0(填“>”或“<”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,则反应在开始时_________进行(填“正向”或“逆向”)。
③实验III中a=______,达平衡时实验II和实验III中H2O(g)的转化率的大小关系为: (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
参考答案:(18分)
(1)SO2+NH3+H2O===NH4+
本题解析:
试题分析:(1)相同物质的量的SO2与NH3溶于水生成NH4HSO3,所以离子方程式为:SO2+NH3+H2O===NH4++HSO3-;根据电荷守恒可得:c(H+)+c(NH4+)=c(OH?)+c(HSO3?)+2c(SO32?),所以c(H+)—c(OH?)= +c(HSO3?)+2c(SO32?)—c(NH4+),根据物料守恒可得:c(NH4+)+c(NH3?H2O)=c(HSO3?)+c(H2SO3)+c(SO32?),与电荷守恒式相减可得:c(H+)—c(OH?)=c(SO32?)+c(NH3?H2O)—c(H2SO3),故答案为BD。
(2)①根据O22?移动方向可知乙为原电池的正极,发生还原反应。
②根据示意图可知NO在甲电极上与O2?反应生成NO2,电极方程式为:NO-2e-+O2-===NO2。
(3)①对比实验I与实验II数据可知,温度升高,CO的转化率减小,所以正反应为放热反应,故?H < 0。
②根据表中650℃时数据可知:H2O(g)+CO(g)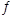 CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol?L?1) 1 2 0 0
转化浓度(mol?L?1) 0.8 0.8 0.8 0.8
平衡浓度(mol?L?1) 0.2 1.2 0.8 0.8
则650℃时平衡常数K=0.8×0.8/(0.2×1.2)=2.67,充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,浓度商Q==0.5×1/(1×0.5)="1" < K,所以开始时反应向正反应方向进行。
③根据表中反应II的数据,CO、H2O的转化量为0.4mol,则反应III的转化量也是0.4mol,所以平衡时a=1mol—0.4mol=0.6mol;实验II中H2O的初始量为1mol、CO的初始量为2mol,实验III中H2O的初始量为2mol、CO的初始量为1mol,所以实验IIH2O的转化率大于实验III。
考点:本题考查离子浓度比较、原电池原理、化学平衡常数、化学平衡。
本题难度:困难
4、选择题 下列说法正确的是
A.明矾水解形成的Al(0H)3胶体能杀菌消毒,可用于水的净化
B.镀锡的铁制品比镀锌的铁制品耐用
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HC1和CH3COOH恰好中和时,消耗NaOH的物质的量相同
参考答案:D
本题解析:
试题分析:A、明矾水解出的氢氧化铝胶体有吸附性,所以能做净水机,但不能杀菌消毒,所以不选A;B、镀锡铁的镀层破坏后,铁做原电池的负极,腐蚀更快,而镀锌铁的镀层破坏后铁做原电池的正极,仍被保护,所以不选B;C、乙醇是非电解质,乙酸是电解质,所以不选C;D、等物质的量的盐酸和醋酸和氢氧化钠反应,根据方程式,需要的氢氧化钠的物质的量相等,所以选D。
考点:明矾的用途,原电池的应用,电解质的定义,酸碱中和。
本题难度:一般
5、填空题 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
向2支盛有1 mL 1 mol·L-1的MgCl2溶液中各加入10滴2 mol·L-1 NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如下表:
实验序号
| 加入试剂
| 实验现象
|
Ⅰ
| 4 mL 2 mol·L-1 HCl 溶液
| 沉淀溶解
|
Ⅱ
| 4 mL 2 mol·L-1 NH4Cl 溶液
| 沉淀溶解
(1)从沉淀溶解平衡的角度解释实验Ⅰ的反应过程 。
(2)测得实验Ⅱ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因 。
(3)甲同学认为应补充一个实验:向同样的Mg(OH)2沉淀中加4 mL蒸馏水,观察到沉淀不溶解。该实验的目的是 。
(4)同学们猜测实验Ⅱ中沉淀溶解的原因有两种:一是NH4Cl溶液显酸性,溶液中的H+可以结合OH- ,进而使沉淀溶解;二是 。
(5)乙同学继续进行实验:向4 mL 2 mol·L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,向同样的Mg(OH)2沉淀中加入该混合溶液,观察现象。
①实验结果证明(4)中的第二种猜测是成立的,乙同学获得的实验现象是 。
③乙同学这样配制混合溶液的理由是 。
参考答案:(1)Mg(OH)2(s)  本题解析: 本题解析:
试题分析:(1)Mg(OH)2存在沉淀溶解平衡:Mg(OH)2(s)  Mg2+(aq)+2OH -(aq),加入HCl后,H+与OH?反应,使OH?浓度减小,沉淀溶解平衡向右移动,Mg(OH)2沉淀溶解。 Mg2+(aq)+2OH -(aq),加入HCl后,H+与OH?反应,使OH?浓度减小,沉淀溶解平衡向右移动,Mg(OH)2沉淀溶解。
(2)NH4Cl为强酸弱碱盐,NH4+发生水解反应,离子方程式为:NH4++H2O  NH3·H2O+H+ NH3·H2O+H+
(3)实验Ⅰ、Ⅱ加入溶液,水增多,所以该实验的目的是:排除实验Ⅰ、Ⅱ中溶剂水使沉淀溶解的可能性。
(4)NH4+能与OH?结合,生成弱电解质NH3?H2O,所以溶液中c(NH4+)较大,NH4+结合OH-使沉淀溶解。
(5)①所加的混合液pH约为8,为碱性,所以沉淀溶解,可证明第二种猜测成立。
②混合液pH约为8,显碱性,c(H+)非常小,而NH4+少量溶解,c(NH4+)浓度较大,可确定沉淀溶解的原因是NH4+与OH?反应,促进沉淀溶解平衡向右移动。
考点:本题考查沉淀溶解平衡、盐类的水解、实验方案的分析。
本题难度:困难
|