微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中有关物质的浓度关系正确的是(?)
A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)> c[(NH4)2SO4]> c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.1.0 mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
参考答案:C
本题解析:
试题分析:A、c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4Cl)>c(NH4HSO4)> c[(NH4)2SO4],错误;B、违背电荷守恒,错误;C、根据碳酸钠溶液中的质子守恒知,1.0 mol/L Na2CO3溶液中:
c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),正确;D、根据溶液中电荷守恒知,某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),错误。
本题难度:一般
2、选择题 将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法错误的是
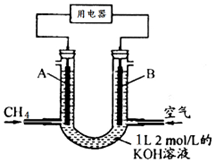
A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+2KOH=K2CO3+3H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32- +3H2O=10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为: c(CO32- )>c(HCO3- )>c(OH-)
参考答案:D
本题解析:
试题分析:A项中,CH4失去电子,电子流出,故通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极,正确;
B项中,0<V≤22.4L,即2n(CH4)≤n(KOH),产物为K2CO3,电池总反应的化学方程式为:CH4+2O2+2KOH=K2CO3+3H2O
C项中,22.4L<V≤44.8L,即n(KOH)≤2n(CH4)≤2n(KOH),产物由K2CO3转向KHCO3,故负极电极反应为:CH4-8e-+9CO32- +3H2O=10HCO3-,正确;
D项中,V=33
本题难度:一般
3、填空题 (8分)在世纪之交,罗马尼亚的炼金废水汇入尼罗河,导致大量鱼类等水生物死亡,造成世界级 的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结
的水污染事件。炼金废水中含有络离子[Au(CN)2]-,它能电离出有毒的CN-,当CN-与H+结 合时生成剧毒的HCN。完成下列问题:
合时生成剧毒的HCN。完成下列问题:
(1)HCN的水溶液酸性很弱,其电离方程式为_________________,NaCN的水溶液呈碱性是因为_________________(用离子方程式表示)。
(2)室温下,如果将0.1mol NaCN和0.05mol HCl全部溶于水,形成混合溶液(假设无损失),
①__????????????_和_??????????__两种粒子的物质的量之和等于0.1mol。
②_????????__和_??????????__两种粒子的物质的量之和比H+多0.05mol。
参考答案:(共8分,2+2+1+1+1+1)
(1)HCN
本题解析:略
本题难度:一般
4、填空题 5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子
| Na+ Al3+???Fe3+ Cu2+、 Ba2+
|
阴离子
| OH- Cl- CO32- NO3- SO4-
?
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A、C的化学式为:A?????????????;C?????????????。
(2)写出步骤②中发生反应的化学方程式???????????????????????????????????。
(3)D溶液中滴入石蕊试液,现象是??????????????????????????????????????????,
原因是????????????????????????????????????????????(用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是???????????????mL。
(5)现用500 mL 3 mol·L-1的E溶液充分吸收11.2 L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为????????????????????????????????。
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水)。
 ’ ’
参考答案:(1)CuSO4? Ba(OH)2(各1分)
(2)2
本题解析:
试题分析:由①知,A、C反应产生的沉淀中应是氢氧化铜和硫酸钡沉淀;则A、C是CuSO4、Ba(OH)2中的一种;由②知,B、E只能是盐类,双水解产生气体和沉淀,其中含有Fe3+、CO32-,且其中必有Na2CO3;由③知C为强碱,所以C是Ba(OH)2,A是CuSO4;D为铝盐;由②④知,E为Na2CO3;由⑤知D中有NO3-,所以D为Al(NO3)3,则B只能为FeCl3。
(1)A、C的化学式为:CuSO4、Ba(OH)2
(2)步骤②是Fe3+、CO32-的双水解反应,化学方程式
本题难度:困难
5、选择题 将0.2 mol/L的HX溶液和0.1mol/L的NaOH溶液等体积混合(忽视混合前后溶液体积的变化),下列关系式中一定不正确的是
A.c(HX) >c(X—)
B.c(Na+)<c(X—)
C.c(H+)+c(Na+) = c(OH—)+c(X—)
D.c(HX)+c(X—)="0.2" mol/L
参考答案:D
本题解析:0.2 mol/L的HX溶液和0.1mol/L的NaOH溶液等体积混合,即混合后,HX过量,溶液中的溶质为NaX、HX;所以,A正确,若HX的电离程度小于X—的水解程度,c(HX) >c(X—);B正确,因HX的物质为NaOH的2倍;C正确,溶液呈电中性的,所以有c(H+)+c(Na+) = c(OH—)+c(X—);D错,混合后,溶液体积为原来2倍,即c(HX)+c(X—)="0.1" mol/L;
本题难度:一般
|