微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。 请回答下列问题:
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,基态镍原子M层上的未成对电子数为____。
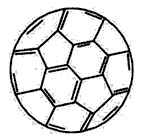
(2)大阪大学利用高纯度的C60将有机太阳能电池效率提高至5.3%。C60分子的结构如图所示,其中碳原 子轨道的杂化类型为____,1 molC60分子中含____mol σ键。
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)及 铜锢硒(Se)薄膜电池等。
①第一电离能:As____(填“>”、“<”或“=”)Ga。
②SeO2分子的空间构型为________。
(4)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配 合物的结构如图(图 中“→”表示配位键)。该配合物的配位原子是____,配位数为_________ 。

2、选择题 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是 [???? ]
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C.向反应后的溶液加入乙醇,溶液将会没有发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
3、选择题 下列物质中存在配位键的是( )
①H3O+ ②[B(OH)4]- ③CH3COO- ④NH3 ⑤CH4.
A.①②
B.①③
C.④⑤
D.②④
4、填空题 (1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为___________;O22+中键数目和键数目之为________。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为__________;Cu+的配位数为__________。
(3)乙炔与氢氰酸反应可得丙烯腈。丙烯腈分子中碳原子轨道杂化类型是_______________。
(4)在合成氨反应中,催化剂铁表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比为
_______。

5、选择题 下列关于各配合物的稳定性,判断不正确的是[???? ]
A.[Fe(CN)6]3->[Fe(SCN)6]3-
B.[HgCl4]2->[HgF4]2-
C.[AlF6]3->[AdBr6]3-
D.[Cu(NH3)4]2+>[Zn(NH3)4]2+