微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
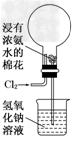
1、选择题 上图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
 [???? ]
[???? ]
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体
参考答案:B
本题解析:
本题难度:简单
2、选择题 已知Cu(NO3)2在加热分解时生成CuO、NO2和O2。下列关于该反应说法正确的是(??)
A.将生成的气体用水充分吸收,剩余O2
B.Cu(NO3)2既被氧化,又被还原
C.每生成1 mol O2,转移电子2 mol
D.NO2用足量的NaOH溶液吸收,产物为NaNO3和水
参考答案:B
本题解析:硝酸铜分解的方程式为2Cu(NO3)2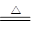 2CuO+4NO2↑+O2↑,所以这是一个氧化还原反应,硝酸铜既是氧化剂,又是还原剂。其中NO2是还原产物,氧气是氧化产物,所以反应中转移电子的物质的量是4mol,因此B正确,C不正确。NO2和氧气溶于水的方程式为4NO2+O2+2H2O=4HNO3,所以选项A是错误的。N
2CuO+4NO2↑+O2↑,所以这是一个氧化还原反应,硝酸铜既是氧化剂,又是还原剂。其中NO2是还原产物,氧气是氧化产物,所以反应中转移电子的物质的量是4mol,因此B正确,C不正确。NO2和氧气溶于水的方程式为4NO2+O2+2H2O=4HNO3,所以选项A是错误的。N
本题难度:一般
3、选择题 含n g硝酸的稀溶液恰好和m g铁粉完全反应若有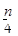 g HNO3被还原成NO,n:m可能
g HNO3被还原成NO,n:m可能
A.1:1
B.2:1
C.3:1
D.9:2
参考答案:CD
本题解析:此题可以用极限法求解。假设一,铁粉刚好完全消耗干净,只能还原n/4g硝酸,那就有方程表达:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,理清关系有:Fe~NO,可看出被氧化的铁粉与被还原的硝酸(根据元素守恒)具有相同的物质的量,于是有计算式m/56=n÷4÷63由此推出n:m=9:2
假设二,铁粉过量,硝酸被完全消耗,甚至连三价铁离子也被铁单质全部还原成亚铁离子。在这种情况下,根据氧化还原反应电子得失守恒,mg铁粉提供电子总物质的量为m÷56×2=m/28mol,而硝酸得到的电子为,n÷4÷
本题难度:一般
4、选择题 0.75 mol·L-1的NaOH溶液200 mL和0.5 mol·L-1的H3PO4溶液200 mL混合,生成盐的物质的量浓度接近(???)
A.NaH2PO4和Na2HPO4溶液的浓度均为0.2 mol·L-1
B.Na2HPO4和NaH2PO4溶液的浓度均为0.125 mol·L-1
C.0.15 mol·L-1的Na2HPO4和0.10 mol·L-1的NaH2PO4
D.0.1 mol·L-1的Na2HPO4和0.1 mol·L-1的Na3PO4
参考答案:B
本题解析:n(NaOH)="0.75" mol·L-1×0.2 L="0.15" mol
n(H3PO4)="0.5" mol·L-1×0.2 L="0.1" mol,则n(NaOH)∶n(H3PO4)=3∶2,可写出方程式:
2H3PO4+3NaOH====Na2HPO4+NaH2PO4+3H2O,故n(Na2HPO4)=n(NaH2PO4)=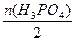 本题难度:简单
本题难度:简单
5、选择题 以下物质受热后均有气体产生,其中不产生红棕色气体的是
A.浓硫酸和溴化钠混合物
B.浓硝酸和木炭混合物
C.固体硝酸钙
D.浓硝酸
参考答案:C
本题解析:分析:A.?浓硫酸具有强氧化性,能氧化HBr生成红棕色的溴蒸气;
B.硝酸具有氧化性,能将单质碳氧化,硝酸被还原,生成二氧化氮和二氧化碳和水,二氧化氮气体为红棕色;
C.固体硝酸钙受热生成无色的氧气;
D.纯净的浓硝酸在常温下见光或受热就会分解,生成红棕色的二氧化氮气体.
解答:A.浓硫酸和溴化钠混合物受热后2NaBr+H2SO4(浓) Na2SO4+2HBr↑,浓硫酸具有强氧化性,易与HBr发生氧化还原反应,H2SO4(浓)+2HBr
Na2SO4+2HBr↑,浓硫酸具有强氧化性,易与HBr发生氧化还原反应,H2SO4(浓)+2HBr Br2↑+SO2↑+2H2O,生成的溴蒸气为红棕色,故A正确;
Br2↑+SO2↑+2H2O,生成的溴蒸气为红棕色,故A正确;
B.浓硝酸与木炭加热时发生氧化还原反应,碳被浓硝酸氧化成二氧化碳,浓硝酸被还原成二氧化氮,C+4HNO3(浓) 2H2O+CO2↑+4NO2↑,二氧化氮气体为红棕色气体,故B正确;
2H2O+CO2↑+4NO2↑,二氧化氮气体为红棕色气体,故B正确;
C.硝酸钙加热于132℃分解,加热至495~500℃时会分解为氧气和亚硝酸钙,生成的氧气为无色气体,故C错误;
D.硝酸化学性质不稳定,硝酸见光或受热分解,4HNO3 2H2O+4NO2↑+O2↑,生成的二氧化氮气体为红棕色,故D正确;
2H2O+4NO2↑+O2↑,生成的二氧化氮气体为红棕色,故D正确;
故选C.
点评:本题主要考查了硝酸、浓硫酸的化学性质,掌握常见的红棕色气体是解答本题的关键,平时须注意积累相关反应知识,题目难度不大.
本题难度:一般