?
(1)由NO与HNO3的关系可知,稀硝酸的物质的量浓度为_______ mol·L-1。
(2)稀硝酸的密度为__________g/cm3。
(3)放出2240 mL气体时,反应的离子方程式是_____________________________,放出4480 mL气体时,消耗金属的质量为_______g。
(4)原混合物中铁和铜的物质的量比为__________。
(5)加入400 mL稀硝酸,反应完全后,溶液中NO3-的物质的量为________mol。
(6)当溶液中Cu2+、Fe2+的物质的量浓度相等时,放出气体的体积_________mL(标准状况下)。
参考答案:(本题共16分)
(1)? 4??(2分)?(2)?
本题解析:略
本题难度:困难
2、选择题 某稀硝酸与铜反应缓慢,为了提高该化学反应的反应速率,下列措施中不可取的是(???)
A.微热
B.加入少量烧碱
C.滴入少量浓硫酸
D.滴入少量浓硝酸
参考答案:B
本题解析:B项中加入烧碱后,发生中和反应,减小了溶液中的c(H+),使反应速率减小。
本题难度:简单
3、选择题 砒霜中毒事件时有发生,砒霜的主要成分是三氧化二砷(As2O3),医生通常给砒霜中毒患者服用一定剂量的氧化剂解毒。下列有关叙述正确的是
A.砷原子最外层有3个电子
B.砷化氢(AsH3)比NH3稳定
C.砷的+3价化合物有一定的还原性
D.砷酸(H3AsO4)的酸性强于磷酸
参考答案:C
本题解析:砷为第四周期、第VA族元素,原子最外层为5个电子;同周期自上而下非金属性逐渐减弱,其氢化物的稳定性及最高价氧化物的水化物的酸性也依次减弱;排除ABD
砷元素的+3价为中间价,同时结合题意可知,C项正确
本题难度:一般
4、填空题 (4分)NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”。请回答下列问题。
(1)NO的危害在于????????????(填以下项目的编号)
A.破坏臭氧层
B.高温下能使一些金属氧化
C.造成酸雨
D.与人体血红蛋白结合
(2)在含Cu+ 离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+ 和亚硝酸根离子(NO2-)在酸性水溶液中反应的离子方程式: 。
参考答案:(1)ACD??(2)Cu+ + NO2- +
本题解析:略
本题难度:简单
5、实验题 某化学课外活动小组通过实验研究NO2的性质.
已知:2NO2+2NaOH═NaNO3+NaNO2+H2O
利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)
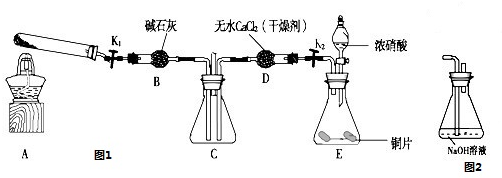
(1)E装置中制取NO2反应的离子方程式是 ??????????????????????????
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取 (?????)
a.NH4HCO3?????b.NH4Cl?????c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是 ????????????????????????
(4)此实验装置存在一个明显的缺陷是 ????????????????????????????????????????????
(5)探究NO2能否与Na2O2发生氧化还原反应.为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.装置的合理连接顺序是 ??????????????????????????????????????????
(6)实验过程中,B装置中淡黄色粉末逐 渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为???????????????????????????????
参考答案:(1) Cu+4H++2NO3-═Cu2++2NO2↑+2H
本题解析:
试题分析:(1)浓硝酸与Cu反应的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O 。(2)用一种固体物质加热制取NH3,要用a NH4HCO3分解的方法。NH4HCO3 NH3↑+H2O+ CO2↑.不能用加热NH4Cl的方法。因为:NH4Cl NH3↑+H2O+ CO2↑.不能用加热NH4Cl的方法。因为:NH4Cl 本题难度:一般 本题难度:一般
|