微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把1mL0.1mol/L的H2SO4加水稀释制成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于[???? ]
A.1×10-4mol/L
B.1×10-8mol/L
C.1×10-11mol/L
D.1×10-10mol/L
参考答案:D
本题解析:
本题难度:一般
2、填空题 写出下列物质的电离方程式:
HNO3______
Ba(OH)2______
KClO3______.
参考答案:硝酸是强电解质,能完全电离,电离方程式为:HNO3=H++N
本题解析:
本题难度:一般
3、选择题 常温下,下列关于酸碱反应的说法正确的是( )
A.用pH=2和pH=3的醋酸溶液中和含等量NaOH的溶液所消耗醋酸溶液体积分别为Va、Vb,则Vb <10Va
B.pH=2的HCl与pH=12的NH3·H2O 等体积混合后溶液是酸性
C.向体积为V1L的浓度均为0.1mol/L HCl、CH3COOH混合溶液中加入 V2 L 0.2mol/L的NaOH溶液后,溶液呈中性,则V1>V2
D.pH为2的硫酸与0.01mol/L的NaOH溶液等体积混合后,混合溶液显酸性
参考答案:C
本题解析:
试题分析:A.对于弱酸醋酸来说,pH越小,酸的浓度越大电离的程度就越小。当中和等量NaOH的溶液所消耗醋酸溶液体积就越小,所以pH=2和pH=3的醋酸溶液体积分别为Va、Vb,则Vb >10Va,错误;B.盐酸是强酸,完全电离,一水合氨是弱碱,部分电离,所以pH=2的HCl与pH=12的NH3·H2O 等体积混合后,电离的碱恰好与酸中和,但是为电离的碱会继续电离,最终使溶液显碱性,错误;C.两种一元酸的浓度、体积相同,则二者的物质的量相同,向其中加入同一浓度的碱至溶液呈中性时,由于CH3COOH是弱酸,若完全与NaOH恰好反应产生的盐是强碱弱酸盐,水解使溶液显碱性,所以消耗的NaOH的体积就比强酸少些,因此溶液呈中性时,消耗的NaOH的体积是V1>V2,正确;D.pH为2的硫酸与0.01mol/L的NaOH溶液等体积混合后,二者恰好中和,所以混合溶液显中性,错误。
考点:考查关于酸碱反应的溶液的酸碱性及消耗的溶液体积的说法的知识。
本题难度:一般
4、填空题 某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
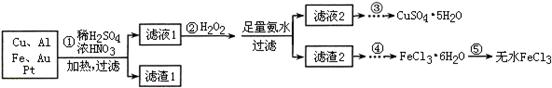
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
实验序号
| 1
| 2
| 3
| 4
|
消耗Na2S2O3标准溶液(mL)
| 25.00
| 25.02
| 26.20
| 24.98
此产品中CuSO4·5H2O的质量分数为 。
参考答案:(1)Cu + 4H+ + 2NO3? = Cu2+ +2N
本题解析:
试题分析:(1)浓硝酸与稀硫酸混合后,可能为浓硝酸也可能为稀硝酸,所以离子方程式为:Cu + 4H+ + 2NO3? = Cu2+ +2NO2↑+ 2H2O或3Cu+8H++2NO3? 3Cu2++2NO↑+4H2O 3Cu2++2NO↑+4H2O
(2)H2O2具有强氧化性,所以H2O2的作用是将Fe2+氧化成Fe3+;加入足量氨水,Fe3+、Al3+转化为Fe(OH)3沉淀和Al(OH)3沉淀,所以滤渣2为Fe(OH)3、Al(OH)3。
(3)FeCl3为强酸弱碱盐,容易发生水解反应:FeCl3+3H2O  Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。 Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。
(4)c2(OH?)?c(Cu2+)= Ksp[Cu(OH)2],代入数据可求出c(OH?)=1.0×10-9mol?L?1,pH=-lgc(H+)=-lg【Kw÷c(OH?)】=5。
(5)Cu2+把I?氧化为I2,加入淀粉溶液变蓝,用Na2S2O3标准溶液滴定,达到滴定终点时,Na2S2O3与I2恰好完全反应,所以达到滴定终点的依据是:溶液由蓝色褪为无色且半分钟内不恢复原色;实验3所测数据明显大于其他3组数据,说明实验3出现了实验错误,应舍去,根据其他3组数据求出平均值,根据2Cu2++4I-= 2CuI↓+I2和I2+2S2O32-= 2I-+S4O62-可得对应关系:S2O32- ~ Cu2+,所以n(CuSO4?5H2O)=n(Cu2+)=n(S2O32- )=0.080 mol·L-1 ×(25.00+25.02+24.98)/3L=0.002mol,所以此产品中CuSO4·5H2O的质量分数为:0.002mol×250g/mol×5÷3.00g×100%=83.3%
考点:本题考查化学流程的分析、化学方程式的书写、盐类水解的应用、pH的计算、氧化还原反应滴定及计算。
本题难度:困难
5、选择题 在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH 溶液,曲线如下图所示,有关粒子浓度关系比较正确的 ( )

A.在A、B间任一点,溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)= c(H+)
C.在C点:c(Na+)>c(CH3COO-) >c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
参考答案:D
本题解析:
试题分析:若加入醋酸溶液很少,则可能出现c(Na+)> c(OH-)>c(CH3COO-) > c(H+),A错误;当加入12.5mL醋酸时,醋酸与氢氧化钠溶液恰好中和生成醋酸钠溶液,溶液呈碱性,而B点pH=7,说明醋酸过量,a>12.5,溶液中电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),由pH=7得c(Na+)=c(CH3COO-)但不等于c(OH-)= c(H+),B错愕;C点为醋酸和醋酸钠混合溶液,电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)>c(OH-)则c(CH3COO-) > c(Na+),C错误;D点为等物质的量CH3COOH与CH3COONa的混合溶液,由物料守恒得c(CH3COO-)+c(CH3COOH)=2c(Na+),D正确。
考点:考查离子浓度大小比较。
本题难度:一般
|