微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)X、Y、Z为周期表中前20号主族元素,原子序数递增,X、Y原子的最外层电子数 是其电子层数的2倍,Z是人体中含量最高的金属元素。
是其电子层数的2倍,Z是人体中含量最高的金属元素。
(1)下列含氧酸根化学式书写不正确的是??????????(填序号)。
a.XO3-??? b.XO32-??? c.YO32-??????d.Y2O32-
(2)X、Y的原子可构成只含极性键的非极性分子;它的电子式是??????????????,空间构型是???????????。
(3)Y的最高价含氧酸是重要的化工产品。
①已知YO2被空气氧化,每生成1mol气态YO3,放出98.3kJ热量。该反应的热化学方程式是??????????????。
②实验测得相同条件下一定量的Y单质分别在空气和在氧气中充分燃烧后产物的成分(体积分数)如表。Y在纯氧中燃烧的产物中YO3含量比空气中少,试分析其原因???????????????????????????????????????。
?
| YO2
| YO3
|
空气
| 94%—95%
| 5%—6%
|
氧气
| 97%—98%
| 2%—3%
2、填空题 (15分)已知:M、E是中学化学常见金属,A是一种氧化物,可用做颜料。根据下列框图(反应条件和部分物质略去)回答下列问题:

⑴写出M溶于稀H2SO4和H2O2混合液的离子方程式:????????????????????????????。
⑵写出实验室常用来检验X溶液阳离子的操作方法和现象?????????????????????。
⑶写出Cl2将Z氧化为K2EO4的化学方程式:????????????????????????????????????。
⑷取X溶液,调pH大于7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗1mol I―时,共转移3 mol电子,该反应的离子方程式是???????????????????????。
(5) K2EO4可用于水源杀菌消毒和净化,原因是________________________________。
3、推断题 F是有机合成中的重要试剂,工业上可用以下流程合成

已知A、B、C为单质,D的水溶液呈碱性。A~F常温F均为气体,除A呈黄绿色外,其余均无色,工业上通过电解饱和食盐水得到A。
(1)常温下向D的水溶液中逐滴加入稀盐酸至pH =7,用一个等式表示所得溶液中所有离子浓度之间的关系:______________
(2)取0.3mol B和0.1 mol C放入容积为1L的密闭容器中,在一定条件下反应,达到平衡后得到0. 12 mol D,此时缩小容器容积为0.5 L,n(D)将____(填“增大”“减 小”或“不变”,下同),反应的平衡常数
_________。
(3)工业上电解饱和食盐水制取A时,A在________极生成。实验室制取A的化学反应方程式为:__________________。
(4)已知反应③中参加反应的A、E物质的量之比为1:2,则F的化学式为:__________。
4、推断题 在如图所示的转化关系中,A~J分别表示中学化学中常见的一种物质,其中部分反应物、 生成物没有列出。已知反应③是一种重要金属的制备反应,A、B、C、D、E、F六种物质中均含有同一种元素。
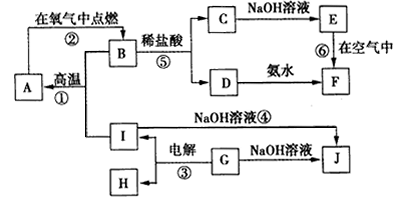
请填写下列空白。
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中的位置是___
(2)写出反应①的化学方程式___。
(3)写出反应⑤的离子方程式_____。
(4)反应③的阳极反应式为__,阴极反应式为___
(5)从能量变化的角度看,反应①②③中属于放热反应的是___(填序号)。
5、填空题 已知物质M由属于同一周期的X.Y两种短周期元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6.M与其他物质的转化关系如下(部分产物已略去):

(1)已知元素Z与Y是最外层电子数相同的短周期元素,那么Z与Y分别与氢形成的氢化物中沸点较高的是______(填化学式),原因是______;
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则E溶液与F溶液反应的离子方程式是:______;
(3)若A是与X、Y同周期元素的一种常见金属单质,且A与B溶液能够反应,则其化学方程式是:______;

(4)若A是一种常见的化肥,式量为79,且E与F生成G时有白烟产生,则A的化学式______,G的电子式是:______;
(5)若A是一种溶液,只可能含有H+.NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积变化如图所示,由此可知,该溶液中肯定含有的离子是______(微粒次序按摩尔质量从小到大,下同),物质的量浓度之比为______.
|