微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:
①1mol H2分子中化学键断裂时需要吸收436kJ的能量
②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量
下列叙述正确的是
[???? ]
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol
B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气与氯气反应生成氯化氢气体的反应是吸热反应
D.氢气和氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol
参考答案:A
本题解析:
本题难度:一般
2、填空题 已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和单质碘反应生成1 mol HI需要 (填“放出”或“吸收”) k J的热量。
参考答案:放出 ; 5.5
本题解析:
试题分析:氢气和单质碘反应的方程式:H2+I2="2HI," 拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J,可知由氢气和单质碘反应生成2mol HI需要放出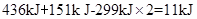 ,而生成1mol HI需要放出
,而生成1mol HI需要放出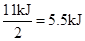
考点:化学反应热量计算
点评:化学反应与能量的变化是高考的一个高考,难度不大,计算量也不大,考生要抓住放热反应反应物总能量大于生成物总能量的特征,即可解答。
本题难度:一般
3、填空题 氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
温度/°C
| 200
| 300
| 400
| 500
| 600
|
氨含量/%
| 89.9
| 71.0
| 47.0
| 26.4
| 13.8
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是 。
(2)根据-4,合成氨的热化学方程式是 。
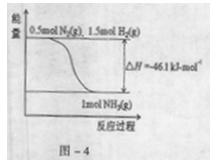
(3)在一定温度下,将2molN2和6molH2通入到体积为1L的密闭容器中,发生反应
N2+3H2  2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)= ;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是 。 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)= ;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是 。
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是 (选填序号字母)
a.及时分离出NH3 b.升高温度
c.增大压强 d.使用催化剂
参考答案: 本题解析:略 本题解析:略
本题难度:一般
4、选择题 下列微粒中,哪一组中的化学键含有非极性共价键:①C2H6?②H2S?③CH2Cl2?④NH4+
A.①②③④
B.只有①
C.只有①③
D.只有②③
参考答案:B
本题解析:
试题分析:由同一种非金属元素组成的共价键是非极性键,据此可知,只有乙烷中含有非极性键,答案选B。
点评:该题是基础性试题的考查,主要是考查学生对非极性键判断的了解掌握情况,旨在巩固学生的基础,提高学生的能力,难度不大。
本题难度:一般
5、填空题 下列表示分子结构的图示中,●表示短周期的几种元素的“原子实”[指原子除去最外电子层电子后剩余的部分,周围小黑点表示没有用于形成共价键的最外层电子,短线代表共价键。例如X2(X代表卤素原子):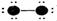
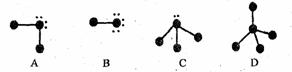
回答下列问题:
(1)A、B、C、D四种“图示”中,所表示的物质可分为四组共_________种分子。这些物质的分子中的电子总数可能为________或________。
(2)分子的空间构型为正四面体的物质的分子式是________________。该组中,物质的稳定性顺序是________________;它们沸点的变化与其余各组相比________________(填“相同”或“不相同”),其原因是 ________________________________________ 。
(3)
写出上述物质中的两种间相互反应生成离子化合物的化学方程式:__________________ 。
参考答案:(1)8、10、18 (2)CH4、SiH4 CH4>S
本题解析:根据题目所给信息可得出:A可表示H2O、H2S;B可表示HF、HCl;C可表示NH3、PH3;D可表示CH4、SiH4。
本题难度:一般
|