微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氢氧化钠与盐酸的反应属于
A.吸热反应
B.放热反应
C.既是吸热反应也是放热反应
D.都不是
参考答案:B
本题解析:
试题分析:氢氧化钠和盐酸发生中和反应,所有的中和反应都是放热反应,故答案选B.
考点:中和反应
本题难度:一般
2、选择题 已知某化学反应中生成物的总能量为60kJ,若该反应是放热反应,则反应物总能量可能为
A.50kJ
B.30kJ
C.80kJ
D.20kJ
参考答案:C
本题解析:
试题分析:由于该反应为放热反应,即反应物的总能量高与生成物的总能量,故反应物的总能量大于60kJ,所以选C.
考点:化学反应的热效应。
本题难度:一般
3、填空题 (12分)回答下列问题
(1)CH4、CO2、COCl2和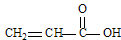 四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
(2)NH3分子的立体构型是___________形,联氨(N2H4)可视为是NH3分子中的一个氢原子被氨基(-NH2)取代所形成的物质,写出联氨加入足量盐酸反应的化学方程式_________________________________________________________________。
(3)H2O、H2O2、OF2和SCl2四种分子中各原子均达8电子结构的分子是________________。
(4)N2H4与H2O2反应:N2H4(l)+2H2O2=N2(g)+4H2O(g) ,若该反应中有4 mol N—H键断裂,则形成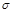 键有_______mol和形成
键有_______mol和形成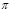 键有_______mol。
键有_______mol。
(5)H2O熔沸点都比H2S高,其原因是___________________________________________。
参考答案:(1) COCl2、 本题解析:(1)甲烷是正四面体型结构,碳原子是sp3杂化。CO2是直线型结构,碳原子是sp杂化。丙烯酸和COCl2中碳原子全部形成1个双键和2个单键,所以是sp2杂化。
本题解析:(1)甲烷是正四面体型结构,碳原子是sp3杂化。CO2是直线型结构,碳原子是sp杂化。丙烯酸和COCl2中碳原子全部形成1个双键和2个单键,所以是sp2杂化。
(2)氨气中的氮原子含有1对孤对电子,所以是三角锥形。由于联氨(N2H4)可视为是NH3分子中的一个氢原子被氨基(-NH2)取代所形成的物质,所以联氨能形成配位键,方程式为N2H4+2HCl=N2H6Cl2。
(3)只有元素的化合价的绝对值和该原子的最外层电子数之和满足8,才能达到8电子稳定结构,所以只有OF2和SCl2分子中各原子均达
本题难度:一般
4、选择题 下列现象不能用氢键解释的是?
A.冰的密度比水小,浮于水面
B.氨气易液化
C.乙醇极易溶于水
D.碘易溶于苯(C6H6)
参考答案:D
本题解析:
试题分析:A.由于在冰中水分子之间存在氢键,使分子之间的距离增大,体积扩大,所以密度变小,密度比水小,浮于水面。错误。B.在氨气的分子之间由于存在氢键,增加了分子之间的作用力,使氨气易液化。错误。C.在乙醇的分子与水的分子之间容易形成氢键,增加了分子之间的作用力,所以乙醇极易溶于水。错误。D.碘和苯都是由非极性分子构成的物质,分子间通过分子间作用力结合。根据相似相容原理,所以碘单质易溶于苯(C6H6)。这与氢键无关。正确。
本题难度:简单
5、选择题 在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ?mol-1(N2的键能为942kJ?mol-1),晶体片段结构如图所示.又发现利用N2可制取出N5、N3.含N5+离子的化合物及N60、N5极不稳定.则下列说法错误的是( )
A.按键型分类,该晶体中含有非极性共价键
B.含N5+离子的化合物中既有离子键又有共价键
C.高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D.这种固体的可能潜在应用是烈性炸药或高能材料
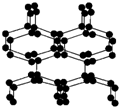
参考答案:A.高聚氮中含N-N键,则该晶体中含有非极性共价键,故A正确
本题解析:
本题难度:简单