微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关化学用语或名称 ,表达错误的是
,表达错误的是
A.葡萄糖的分子式:C6H12O6
B.苯分子的比例模型:
C.乙炔的电子式: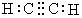

D. 的名称:硝基苯
的名称:硝基苯
参考答案:D
本题解析:略
本题难度:一般
2、选择题 19世纪初,某科学家提出了原子学说,他认为物质由原子组成,原子不能被创造,也不能被毁灭,在化学反应中不能再分,这个科学家是?????????????????? (????)
A.汤姆生
B.道尔顿
C.卢瑟福
D.波尔
参考答案:B
本题解析:略
本题难度:简单
3、选择题 在下列反应中气体反应物只能作还原剂的是 (???)
A.CO2气体通入石灰水:CO2+Ca(OH)2===CaCO3↓+H2O
B.SO2气体通入氢硫酸溶液:SO2+2H2S===3S↓+2H2O
C.CO气体通入盛有灼燃CuO的试管中: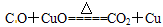
D.将氨气通入硝酸中:NH3+HNO3===NH4NO3
参考答案:C
本题解析:A错误,是非氧化还原反应。
B错误,SO2起氧化剂作用。
C正确。
D错误,D中无元素化合价,变化是非氧化还原反应。所以答案该选C。
本题难度:简单
4、选择题 下列做法中用到物质氧化性的是(?)
A.明矾净化水
B.纯碱除去油污
C.臭氧消毒餐具
D.食醋清洗水垢
参考答案:C
本题解析:明矾净水是胶体的吸附性,不是氧化性;纯碱除去油污是利用碳酸钠的水解显碱性;臭氧消毒利用的是臭氧的氧化性;食醋清洗水垢是利用乙酸的酸性,答案选C。
本题难度:简单
5、填空题 已知制取氯气也可用浓盐酸与高锰酸钾为原料,其化学方程式为
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。请回答下列问题:
(1)用双线桥法标出该化学式电子转移的方向与数目:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(2)反应中被还原的元素为 (写名称);标准状况下当生成112 L氯气时,反应中转移的电子数目为 。
(3)若有4 molHCl被氧化,则可生成标准状况下的氯气 L。
(4)若有1.58g高锰酸钾和100mL10moL/L浓盐酸充分反应(不考虑盐酸挥发,忽略溶液体积的前后变化),反应至终点时高锰酸钾紫色完全褪去,则被氧化的HCl的物质的量
为 mol。将反应后的溶液取出10mL,加入足量的硝酸银溶液,可得到沉淀的物质的量为 mol。
参考答案:(1)略(2分) (2)锰 (2分)
本题解析:
试题分析:(2)氧化还原反应中,氧化剂,得到电子,化合价降低,被还原,发生还原反应,对应的是还原产物,因此可以分析出被还原的是锰元素。当有5mol的氯气生成时,转移的电子总数为10mol,换成微粒数就是: 10NA。
(3)从方程式上可以看出,反应16mol的盐酸,其中被氧化的只有10mol,转移十摩尔的电子,生成5mol的氯气,因此,若有4 molHCl被氧化,则可生成标准状况下的氯气为2mol ,体保为44.8L 。
(4)1.58g高锰酸钾为0.01mol ,反应中可以看出,每反应2mol的KMnO4,则有10mol的盐酸被氧化,因此,当有0.01mol 的高锰酸钾反应时,被氧化的盐酸的物质的量就为:0.05mol。
2KMnO4+10HCl(浓)+6HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
0.01mol 0.05mol
那么溶液中剩余的氯离子的物质的量为:100mL×10moL/L-0.05mol=0.95mol
将反应后的溶液取出10mL,其中的氯离子的物质的量为0.095mol。加入足量的硝酸银溶液,可得到沉淀的物质的量为0.095mol。
考点:氧化还原的有关知识。
本题难度:一般