微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3 + 4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl + 2 H2O
方法二:2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+Na2SO4 + 2 H2O
(1)方法一的离子方程式: ;
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L;在下面的化学式上标出电子转移的方向和数目2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+ Na2SO4 + 2 H2O
参考答案:(1)2ClO3-+ 4 H+ + 2Cl-=2 ClO2↑
本题解析:
试题分析:(1)方法一中的反应只有钠离子和一半的氯离子实际不参加反应,则离子反应为2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,
(2)2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+2Na2SO4+2H2O中,O元素的化合价升高,则H2O2为还原剂被氧化,Cl元素的化合价由+5价降低为+4价,转移1个电子,反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为0.1mol×22.4L/mol=2.24L,故答案为:H2O2;2.24;
单线桥法标出电子转移的方向和数目。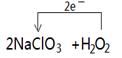
考点:考查离子反应及氧化还原反应
本题难度:一般
2、简答题 已知过氧化钠能与水发生如下反应:2Na2O2+2H2O═4NaOH+O2↑,7.8g过氧化钠与足量水反应后,将会产生多少摩尔NaOH,生成的O2在标准状况下所占的体积是多少?
参考答案:7.8g过氧化钠的物质的量为
本题解析:
本题难度:一般
3、填空题 在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)稀释后的溶液pH= ;
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
参考答案:(1)0 &#
本题解析:
试题分析:(1)因为铜全部溶解,因此溶液中铜离子的物质的量为0.1 mol,那么与铜离子相结合的硝酸根离子的物质的量为0.2 mol。又因为溶液中总的硝酸根离子的物质的量为0.3 mol,所以以硝酸形式存在的离子的物质的量为0.1 mol,也可以理解为溶液中剩余硝酸的物质的量为0.1 mol,那么硝酸的浓度为1mol·L-1,所以其pH=0。(2)若a=9,则题中所提供的硝酸总的物质的量为0.45 mol,减去剩余的0.3mol,那么被还原的硝酸的物质的量为0.15 mol。因为这是一个氧化还原反应,氧化剂所得到的电子与还原剂所失去的电子的物质的量相等,还原剂铜所失去的电子一定为0.2mol,假设反应中生成的二氧化氮的物质的量为x mol, 那么一氧化氮的物质的量就为:(0.15-x)mol,如是有如下关系:
0.2=(0.15-x)×3+x,解之得:x="0.125" mol
考点:考查电子守恒。
本题难度:一般
4、选择题 在一定条件下,RO3n-与R2-发生如下反应:RO3n-+2 R2—+ 6H+ ="3R" + 3H2O,下列关于元素R的叙述中正确的是(??)
A.R原子的最外层上有4个电子
B.RO3n-中的R只能被还原
C.HnRO3一定是强酸
D.R的单质既具有氧化性又具有还原性
参考答案:D
本题解析:
试题分析:A.由于R形成的简单阴离子R2-,所以R原子的最外层上有6个电子.错误。B.根据电子守恒结合方程式RO3n-+2 R2—+ 6H+ ="3R" + 3H2O 可知n=2,RO32-中的R的化合价为+4价,是该元素的中间价态,因此既能被还原 也能被氧化。错误。C.H2RO3一定是弱酸。错误。D.R的单质的价态介于该元素的中间价态,因此既具有氧化性又具有还原性。正确。
本题难度:一般
5、选择题 亚硝酸(HNO2)参加反应时,既可作氧化剂,也可作还原剂。当它作还原剂时,可能生成的产物是
A.NH3
B.N2
C.N2O3
D.HNO3
参考答案:D
本题解析:
试题分析:还原剂失去电子,化合价升高,所以亚硝酸的氧化产物可能是硝酸,答案选D。
点评:该题的关键是明确还原剂的含义,以及常见元素的化合价,然后灵活运用即可,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般