微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 经实验测定,在4 ℃时,水的密度最大,为1 g·mL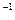 ,请计算一下,4 ℃时1 L水中含有的水分子数为,每个水分子的质量为。
,请计算一下,4 ℃时1 L水中含有的水分子数为,每个水分子的质量为。
参考答案:3.344×10 本题解析:1 L水的质量m:
本题解析:1 L水的质量m:
m="1" L×1 000 mL·L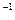 ×1 g·mL
×1 g·mL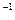 ="1" 000 g
="1" 000 g
1 L水的
本题难度:简单
2、选择题 下列说法正确的是(??? )
A.二氧化碳的相对分子质量是44
B.“物质的量浓度”可简称为“量浓度”
C.阿伏加德罗常数的单位是mol-1
D.1 mol任何物质所占体积都是22.4 L
参考答案:AC
本题解析:A.二氧化碳的相对分子质量是44,正确;
B.“物质的量浓度”是一个整体不能简称为“量浓度”,B错误;
C.阿伏加德罗常数的单位是mol-1,C正确;
D.1 mol任何气态物质在标准状况下所占体积都是22.4 L,固体和液体不是,气体在非标准状况下也不一定是22.4 L,D错误。
选AC
本题难度:简单
3、选择题 物质发生化学反应时,下列数值在反应前后肯定不发生变化的是??(???)
①分子总数?????????????②原子总数???????③电子总数?
④同种元素的化合价?????⑤物质的总质量???⑥物质的总物质的量
A.①②③
B.②③⑤
C.②⑤⑥
D.④⑤⑥
参考答案:B
本题解析:
试题分析:物质发生化学反应时应遵循质量守恒,原子守恒,电子守恒。B选项正确。
本题难度:一般
4、选择题 设NA表示阿伏加德罗常数,下列有关说法正确的是
A.1.0 L 1 mol/L的NaNO3溶液中含有的氧原子数为3NA
B.30 g SiO2晶体中含有Si-O键数目为2NA
C.25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA
D.1mol羟基与1molOH-离子所含电子数均为10NA
参考答案:B
本题解析:
试题分析:A.溶液中除了溶质含有氧元素外溶剂水也含有氧元素。所以氧原子数远远大于为3NA。错误。B.SiO2的摩尔质量是60g/mol,30 g SiO2晶体中含有SiO2的物质的量为0.5mol. 在SiO2晶体中每个硅原子与4个O原子形成4个Si-O键。所以0.5mol SiO2晶体中含有Si-O键数目0.5×4 NA=2NA.正确。数目为2NA C.25℃时,pH=12的NaOH溶液中NaOH电离产生的OH-的数目为0.01NA,此外还有水电离产生的OH-离子。故25℃时,pH=12的NaO
本题难度:一般
5、选择题 100mL?0.3mol/L?Na2SO4溶液和50mL?0.2mol/L?Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度约为( )
A.0.20mol/L
B.0.25mol/L
C.0.4mol/L
D.0.5mol/L
参考答案:100mL?0.3mol/L?Na2SO4溶液中SO42-的
本题解析:
本题难度:一般