微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
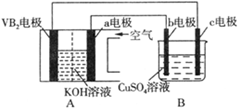
A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+
B.外电路中电子由c电极流向VB2电极
C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L
参考答案:D
本题解析:
试题分析:A、根据装置图可知A是原电池,B是电解池,VB2电极发生氧化反应,失去电子与氢氧根离子结合生成水,碱性溶液中不会产生大量的氢离子,错误;B、a电极是正极,则b电极是阳极,c电极是阴极,则外电路中电子从VB2极流出流向c电极,再从b电极流出,流向a电极,错误;C、电解过程中,铜离子应在阴极析出,即c电极析出红色Cu单质,b电极产生气泡,错误;D、当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体,因为阳极只有氢氧根离子放电生成氧气,通过0.04mol电子,生成氧气的物质的量是0.01mol,标准状况下的体积是0.224L,所以阴极还产生0.224L的氢气,则阴极是铜离子和氢离子放电,产生0.224L氢气转移的电子物质的量是0.02mol,所以铜离子得到电子的物质的量是0.04-0.02=0.02mol,铜离子的物质的量是0.01mol,则硫酸铜溶液的浓度是0.01mol/0.2L=0.05mol/L,正确,答案选D。
考点:考查电化学反应原理的应用
本题难度:一般
2、实验题 (8分)某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为 。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。

正极反应式: ;负极反应式: 。
若该电池中有0.1mol的电子转移,请问消耗 克Fe
方案Ⅲ.结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同): __________________,用离子方程式表示其反应原理:______________
参考答案:(共8分)
方案Ⅰ:Fe+2H+=Fe2++H2↑(1
本题解析:金属的活动性有多种验证方法。例如与水和酸置换氢气的能力;最高价氧化物水化物的碱性强弱;原电池原理;电解原理的应用、金属之间的置换等等。
本题难度:一般
3、选择题 我国首创的海洋电池以铝板为负极,铂网为正,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为: ,下列说法不正确的是(?)
,下列说法不正确的是(?)
A.正极反应为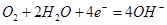
B.电池工作时电流由铝板沿导线流向铂电极
C.以网状的铂为正极,可增大氧气的接触面积
D.该电池只需更换铝板就继续使用
参考答案:B
本题解析:金属铝比铂活泼,所以铝是负极,失去电子,被氧化而溶解。根据总反应式可知,在正极上是溶解在水中的氧气得到电子,发生还原反应。在原电池中电子沿导线传递到正极上,所以正确的答案是B。
本题难度:一般
4、选择题 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是
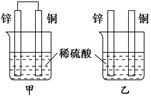
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
参考答案:C
本题解析:甲烧杯中铜片表面有H2产生(原电池),乙烧杯中锌片表面有气泡产生;甲中铜片是正极,乙不是原电池(置换反应);两烧杯中溶液的pH均增大;原电池的原因使产生气泡的速率甲比乙快。
本题难度:一般
5、选择题 归纳法是髙中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低。
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2 :1
③pH相等的三种溶液:a.CH3COONa?? b.NaHCO3??c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B (g)="2C" (g)+D (g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka,醋酸根水解常数为Kb,水的离子积为Kw,则三者关系为:Ka·Kb=Kw
⑥反应A(g)="2" B (g) △H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ.mol-1,则△H=(Ea-Eb)kJ·mol-1
上述归纳正确的是
A.全部
B.③④⑤⑥
C.②④⑤⑥
D.①②④⑤
参考答案:B
本题解析:
试题分析:加水稀释后,酸中的c(H+)减小,但溶液中的c(OH-)增大,①错;pH=2的酸c(H+)=10-2mol·L-1,pH=1的酸c(H+)=10-1mol·L-1,c(H+)之比为1:10,②错;CH3COONa、NaHCO3溶液水解后显碱性,但HCO3-的水解程度大于CH3COO-,因此pH相等时NaHCO3溶液浓度小,NaOH是强碱,相同pH时浓度最小,③正确;该反应是熵增的反应,不能自发进行则△H一定大于0,④正确;醋酸的电离平衡常数 本题难度:一般
本题难度:一般