微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 1g氢气完全燃烧生成液态水放出142.9kJ的热量, 表示该反应的热化学方程式中, 正确的是
A.2 H2(g) + O2(g) =" 2" H2O(l);△H =-142.9kJ/mol
B.2 H2(g) + O2(g) =" 2" H2O(g);△H =-571.6kJ/mol
C.2 H2 + O2 =" 2" H2O;△H =-571.6kJ/mol
D.H2(g) + O2(g) = H2O(l);△H =-285.8kJ/mol
O2(g) = H2O(l);△H =-285.8kJ/mol
参考答案:D
本题解析:生成物水是液态,BC不正确;2g氢气即1mol氢气完全燃烧生成液态水放出的热量142.9kJ×2=285.8kJ,所以D正确,A不正确,答案选D。
本题难度:一般
2、填空题 (16分)Ⅰ.已知:
4Na(g)+3CO2(g)=2Na2CO3(l)+C(s,金刚石) △H=-1080.9kJ/mol
4Na(g)+CO2(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol
试写出固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式 。
Ⅱ.硝基苯甲酸乙酯在OH— 存在下发生水解反应:O2NC6H4COOC2H5+OH-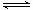 O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示:
t/s
| 0
| 120
| 180
| 240
| 330
| 530
| 600
| 700
| 800
|
α/%
| 0
| 33
| 42
| 49
| 59
| 73
| 74
| 75
| 75
回答下列问题:
(1)该反应在330~530s的平均反应速率为 (只列出算式,不做运算)。
(2)试计算某温度下该反应的平衡常数(写出计算过程)。
(3)为提高O2NC6H4COOC2H5的转化率,可以采取的措施有 ,(写2条)。
Ⅲ.(1)下图装置中,开始电解时,Al电极反应式为 ,石墨电极反应式为 。
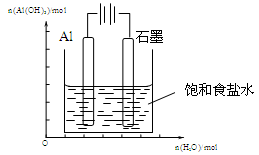
(2)通电一段时间后测得有0.6mol电子转移,作出Al(OH)3物质的量与消耗H2O的物质的量的的图象(反应物足量,作出标注)。
参考答案:Ⅰ.3Na2O(s)+C(s,金刚石) =4Na(g)+Na
本题解析:
试题分析:Ⅰ 由盖斯定律可知:固体Na2O与固体C(金刚石)反应得到气体Na和液态Na2CO3的热化学方程式:3Na2O(s)+C(s,金刚石) =4Na(g)+Na2CO3(l) △H= -3/2×(-357.5kJ/mol)+1/2(-1080.9kJ/mol)= —4.2kJ/mol;Ⅱ、(1)根据速率公式: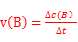 ,该反应在330~530s的平均反应速率为 ,该反应在330~530s的平均反应速率为 mol/(L.s);(2)试计算某温度下该反应的平衡常数,由题意可知: O2NC6H4COOC2H5 + OH- mol/(L.s);(2)试计算某温度下该反应的平衡常数,由题意可知: O2NC6H4COOC2H5 + OH- 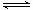 O2NC6H4COO- + C2H5OH O2NC6H4COO- + C2H5OH
起始浓度(mol/L) 0.050 0.050 0 0
变化浓度(mol/L) 0.050 ×75% 0.050 ×75% 0.050 ×75% 0.050 ×75%
平衡浓度(mol/L) 0.050(1-75%) 0.050(1-75%) 0.050 ×75% 0.050 ×75%
则K=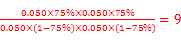 ;(3)为提高O2NC6H4COOC2H5的转化率,即应是平衡正向移动,O2NC6H4COOC2H5+OH- ;(3)为提高O2NC6H4COOC2H5的转化率,即应是平衡正向移动,O2NC6H4COOC2H5+OH-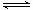 O2NC6H4COO-+C2H5OH为水解反应是吸热反应,故升高温度平衡正向移动,或增大OH-浓度使平衡正向移动增大O2NC6H4COOC2H5的转化率,或分离出乙醇等产物也能使平衡正向移动,故应采取条件为:升高温度或增大OH-浓度或分离出一部分产物;Ⅲ.(1)图装置中,Al电极为阳极,故该电极为Al放电,发生电极反应为2Al-6e-=2Al3+,阴极为水中H+放电,故电极反应为:6H++6e-=3H2 ↑或6H2O+6e-=6OH-+3H2 ↑;(2)通电一段时间后测得有0.6mol电子转移,则消耗水为0.6mol,产生Al(OH)3为0.2mol,故图象为: O2NC6H4COO-+C2H5OH为水解反应是吸热反应,故升高温度平衡正向移动,或增大OH-浓度使平衡正向移动增大O2NC6H4COOC2H5的转化率,或分离出乙醇等产物也能使平衡正向移动,故应采取条件为:升高温度或增大OH-浓度或分离出一部分产物;Ⅲ.(1)图装置中,Al电极为阳极,故该电极为Al放电,发生电极反应为2Al-6e-=2Al3+,阴极为水中H+放电,故电极反应为:6H++6e-=3H2 ↑或6H2O+6e-=6OH-+3H2 ↑;(2)通电一段时间后测得有0.6mol电子转移,则消耗水为0.6mol,产生Al(OH)3为0.2mol,故图象为: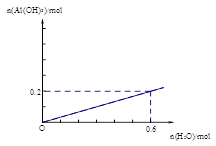 。 。
考点:化学反应原理综合。
本题难度:困难
3、选择题 在298 K、100 kPa时,已知:
2H2O(g)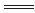 2H2(g) + O2(g) ΔH1 2H2(g) + O2(g) ΔH1
Cl2(g)+H2(g)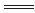 2HCl(g) ΔH2 2HCl(g) ΔH2
2Cl2(g)+2H2O(g)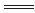 4HCl(g) +O2(g) ΔH3 4HCl(g) +O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
参考答案:A
本题解析:
试题分析:根据盖斯定律分析,反应①+反应②×2=反应③,所以反应热有ΔH3=ΔH1+2ΔH2,选A。
考点:盖斯定律。
本题难度:一般
4、填空题 下表是短周期中部分元素的原子半径及主要化合价。 请回答:
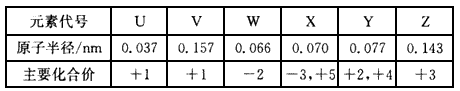
?(1)X在元素周期表中的位置是____。
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是____。(用离子符号表示)。用离子方程式表示出Z离子可作净水剂的原因:____。
(3)某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:____。
(4)1 g YU4气体完全燃烧生成液态水时,放出akJ的热量,则该反应的热化学方程式为________。
(5)现有Z与V2W2的固体混合物样品,加入稀盐酸至混合物完全溶解,所得的混合 液中c(Z3+ ):c(H+):c(Cl-)=1:2:8,则原固体混合物中,Z元素与W元素的质量比为____(最简整数比)。
参考答案:(1)第二周期VA族
(2)O2- >Na+&
本题解析:
本题难度:一般
5、选择题 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H?=?-3677kJ/mol(磷元素被氧化为P4O10),下列有关P4S3的说法中不正确的是?
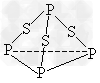 [???? ] [???? ]
A.分子中每个原子最外层均达到8电子稳定结构
B.P4S3中磷元素为+3价
C.热化学方程式为P4S3(?s)+8O2(g)=P4O10(s?)+3SO2(g);△H?=-3?677kJ/mol
D.分子中存在极性键与非极性键
参考答案:B
本题解析:
本题难度:一般
|