微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如下图:
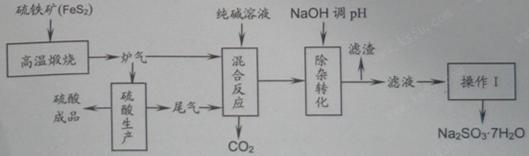
已知:①炉气、尾气中含有SO2;②混合反应中还溶解有少量Fe2O3、MgO等矿尘。
(1)煅烧1molFeS2放出热量为853kJ,则FeS2燃烧的热化学方程式为_____________。
(2)“混合反应”中纯碱(Na2CO3)参与反应的化学方程式为_____________(任写一个)。
(3)用NaOH“除杂”时,主要的离子方程式为_____________(任写一个)。
(4)通过“操作Ⅰ”可以得到亚硫酸钠晶体,写出主要操作步骤的名称:__________。
(3)硫酸生产中炉气转化反应为:2SO2(g)+ O2(g)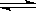 2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
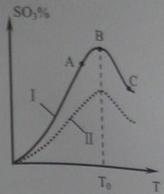
A.该反应的正反应为放热反应
B.曲线Ⅰ上A、C两点反应速率的关系是: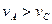
C.反应达到B点时,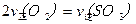
D.已知V2O5的催化效果比Fe2O3好,若Ⅰ表示用V2O5催化剂的曲线,则Ⅱ是Fe2O3作催化剂的曲线
参考答案:(1)4FeS2(S)+11O2(g)=8SO2(g)+2F
本题解析:略
本题难度:简单
2、选择题 下列化肥属于氮肥的是(?????? )
A.NH4Cl
B.KCl
C.(NH4)2SO4
D.K2SO4
参考答案:AC
本题解析:试题分析:氮肥就是以含有氮元素物质为主的肥料,所以答案为AC;BD为钾肥。
本题难度:一般
3、实验题 (16分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
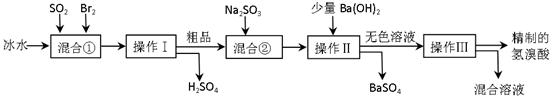
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为?????????。
(2)混合①中使用冰水的目的是??????????????。
(3)操作Ⅱ和操作Ⅲ的名称分别是????????、???????。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体???? b.固体和固体???? c.互不相溶的液体?? d.互溶的液体
(4)混合②中加入Na2SO3的目的是???????????????????????????????。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为????????????,若假设成立可观察到的现象为?????????????????。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为????????????。
参考答案:
(1)SO2+Br2+2H2O → 2HBr+H2S
本题解析:略
本题难度:简单
4、填空题 (10分)硝酸工业在国民经济、国防工业和航天事业中占有重要地位。随着化学纤维、近代有机合成、火箭、导弹等工业的迅速发展,需要使用大量的硝酸。
(1)工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸。写出用铂铑合金作催化剂由氨氧化制备硝酸的第一步反应的化学方程式?? ▲??。浓硝酸和浓硫酸的混合酸是有机合成中常用的硝化剂,写出将苯滴入浓硝酸和浓硫酸混合液中,并在50℃--60℃反应的化学方程式?? ▲??。
(2)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3?→?Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。则硝酸在该反应中的作用是?? ▲??。如果得到的NO和NO2物质的量相同,写出并配平该反应的离子方程式?? ▲??,0.6mol Cu被硝酸完全溶解后,若用排水法收集这些气体,可得标准状况下的气体体积为?? ▲??。
参考答案:(10分)
(1) 4NH3+5O2 ??????4N
本题解析:略
本题难度:一般
5、选择题 工业上用来合成氨的原料之一是氢气,有一种来源是取自石油气,有人设计了以下反应途径,假设反应都能进行,其中最合理的是 [???? ]
A. C3H8 C+H2 C+H2
B. C3H8 C3H6+H2 C3H6+H2
C. C3H8+H2O CO+H2 CO+H2
D. C3H8+O2→CO2+H2O;H2O O2+H2 O2+H2
参考答案:C
本题解析:
本题难度:简单
|