微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果。
已知:C(s)+O2(g)  CO2(g) △H=-393kJ?mol-1;
CO2(g) △H=-393kJ?mol-1;
2CO (g)+O2(g)  2CO2(g) △H=-566kJ?mol-1;
2CO2(g) △H=-566kJ?mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为 。
(2))将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组序
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
H2O
| CO
| CO2
|
1
| 500
| 4
| 8
| 3.2
| 4
|
2
| 750
| 2
| 4
| 0.8
| 3
|
3
| 750
| 2
| 4
| 0.8
| 1
①该反应的正反应为 (填“吸热”或“放热”)反应。
②实验1中,0~4min时段内,以v(H2)表示的反应速率 为 。
③实验2达到平衡时CO的转化率为 。
④实验3与实验2相比,改变的条件是 ;
请在下图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注。
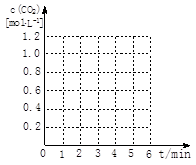
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。 2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为 。
参考答案:(1)(2分)C(s)+H2O(g) 本题解析: 本题解析:
试题分析:(1)已知:①C(s)+O2(g)  CO2(g) △H=-393kJ?mol-1;②2CO (g)+O2(g) CO2(g) △H=-393kJ?mol-1;②2CO (g)+O2(g)  2CO2(g) △H=-566kJ?mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1,根据盖斯定律:①—②×1/2—③×1/2得该反应的热化学方程式为C(s)+H2O(g) 2CO2(g) △H=-566kJ?mol-1;③2H2(g)+O2(g)=2H2O(g) △H=-484kJ?mol-1,根据盖斯定律:①—②×1/2—③×1/2得该反应的热化学方程式为C(s)+H2O(g)  CO(g)+H2(g) △H=+132kJ?mol-1;(2)①根据题给反应和等效平衡知识知,温度为500℃时,起始容器中加入2molH2O、4molCO时,达平衡后CO2的物质的量为1.6mol,750℃时达平衡后CO2的物质的量为0.8mol,则升高温度,平衡逆向移动,该反应的正反应为放热反应。②根据题给反应知,v(H2)= v(CO2),实验1中,0~4min时段内,v(H2)=3.2÷(1×4)="0.8" mol/(L·min);③分析题给数据知,实验2达到平衡时CO的转化率=0.8/4×100%=20%;④实验3与实验2相比,化学平衡没有移动,只是缩短了达平衡时间,容器的体积恒定为1L,故改变的条件是加催化剂;图像见答案;(3)电解过程中若阳极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O;(4)将CO通入银氨溶液中可析出黑色的金属颗粒银,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。 CO(g)+H2(g) △H=+132kJ?mol-1;(2)①根据题给反应和等效平衡知识知,温度为500℃时,起始容器中加入2molH2O、4molCO时,达平衡后CO2的物质的量为1.6mol,750℃时达平衡后CO2的物质的量为0.8mol,则升高温度,平衡逆向移动,该反应的正反应为放热反应。②根据题给反应知,v(H2)= v(CO2),实验1中,0~4min时段内,v(H2)=3.2÷(1×4)="0.8" mol/(L·min);③分析题给数据知,实验2达到平衡时CO的转化率=0.8/4×100%=20%;④实验3与实验2相比,化学平衡没有移动,只是缩短了达平衡时间,容器的体积恒定为1L,故改变的条件是加催化剂;图像见答案;(3)电解过程中若阳极为溶液中的OH-放电,则阳极的电极反应式为4OH--4e-=O2↑+2H2O;(4)将CO通入银氨溶液中可析出黑色的金属颗粒银,其反应方程式为CO+2Ag(NH3)2OH=2Ag↓+(NH4)2CO3+2NH3。
考点:考查热化学方程式书写、盖斯定律,化学反应速率和化学平衡,电极反应式、化学方程式的书写。
本题难度:困难
2、选择题 下列关于甲、乙、丙、丁四幅图说法正确的是
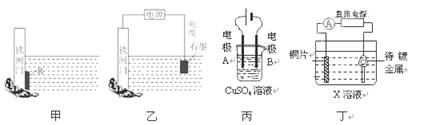
A.装置甲中对于铁闸门的保护用的是“牺牲阳极的阴极保护法”,焊接在铁闸上的金属R可以是锡块
B.装置乙中对于铁闸门的保护采用的是“外加电流的阴极保护法”,铁闸门应与直流电源的负极相连
C.装置丙可实现电解精炼铜,电极A的材料用纯铜,电极B的材料用粗铜
D.装置丁可实现镀铜,铜片接在电源的正极,待镀金属接在电源的负极,X溶液应用含有待镀金属阳离子的溶液
参考答案:B
本题解析:
试题分析:铁的活泼性强于锡的,A不正确,应该用锌快;C不正确,粗铜精炼时,粗铜做阳极,和电源的正极相连;D不正确,X溶液应用含有镀层金属阳离子的溶液,答案选B。
点评:该题是电化学的综合应用,试题基础性强,难度不大。该题的关键是明确电化学的原理,然后结合题意灵活运用即可,有助于培养学生的逻辑思维能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
3、选择题 锌和二氧化锰是电池工业中的主要原料,其中一种Zn-MnO2同槽电解的工业生产流程涉及的主要反应有:①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O,②MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4下列说法正确的是 [???? ] MnO2+Zn+2H2SO4下列说法正确的是 [???? ]
A.①中MnO2是氧化剂,ZnSO4是还原产物
B.①中每产生16 g S时转移电子的物质的量为2 mol
C.按照②电解时,生成MnO2的电极为阴极
D.该工艺流程体现了高效和可循环性
参考答案:D
本题解析:
本题难度:简单
4、选择题 氯碱工业中,与铁丝网连接的是电源的?????????????(???)
A.负极
B.正极
C.阴极
D.阳极
参考答案:A
本题解析:在氯碱工业中,发生反应的方程式为: ===== =====
本题难度:简单
5、选择题 科学家P.Tatapudi等人首先使用在空气中电解水(酸性条件下)的方法在阳极制得臭氧,阴极制得过氧化氢。电解总方程式为:3H2O+3O2??3H2O2+O3,下列说法正确的是
A.电解产物在应用中都只能作为氧化剂
B.电解一段时间后,溶液pH不变
C.每生成1 mol O3转移电子数为3 mol
D.阳极的反应:3H2O→O3+6H++6e-
参考答案:D
本题解析:电解池的阳极反应为:3H2O—6e—=O3+6H+;阴极反应为:3O2+6e—+6H+
A:H2O2即可做氧化剂,也可做还原剂,不正确
B:由于H2O2呈酸性,故溶液的pH减小
C:由电极反应式可知,每生成1 mol O3转移电子数为6mol
D:正确
本题难度:一般
|