微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 实验室也可用反应2KMnO4+16HCl(浓)=2KCl+2M来源:91考试网 91exam.orgnCl2+5Cl2↑+8H2O来快速制取氯气。
(1)请标出电子的转移方向和数目
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)若产生标准状况下Cl2 11.2L,则反应过程中转移的电子数为________???????,被氧化的还原剂
的物质的量为___________。
(3)需消耗36.5%的浓盐酸多少质量?
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;锰元素化合价从+7价降低到+2价,得到5个电子;氯元素化合价从-1价升高为0价,失去1个电子,所以双线桥表示为: ;
;
(2)依据化学方程式和元素化合价变化判断电子转移,计算被氧化的物质的量;2KMnO4+16
本题难度:一般
2、填空题 (8分)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生如下离子反应:
(1)配平: 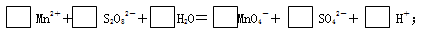
(2)该反应常用于检验Mn2+的存在,其特征现象是___________________________________。
(3)若反应中有0.1 mol还原剂参加反应,则转移电子数为________NA,消耗氧化剂的物质的量______________mol。
参考答案:(8分)(1)2Mn2++5S2O82—+8H2O=2MnO
本题解析:
试题分析:(1)根据氧化还原反应中电子守恒、元素守恒和电荷守恒,该反应的方程式是:2Mn2++5S2O82—+8H2O=2MnO4—+10SO42—+16H+;(2)该反应常用于检验Mn2+的存在,若存在Mn2+,则反应后溶液的颜色会由无色变为紫色;(3)根据方程式可知:若反应中有0.1 mol还原剂参加反应,则转移电子数为0.5 NA,反应消耗氧化剂的物质的量0.25mol。
考点:考查氧化还原反应方程式的配平、应用及相应的计算的知识。
本题难度:一般
3、选择题 化学反应SO2+H2O+HNO3-H2SO4+NO经配平后,还原剂的化学计量数为( )
A.1
B.2
C.3
D.4
参考答案:SO2+H2O+HNO3-H2SO4+NO,该反应中化合价的
本题解析:
本题难度:简单
4、选择题 有Fe2+、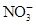 、Fe3+、
、Fe3+、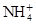 、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是(?? )
、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是(?? )
A.氧化剂与还原剂的物质的量之比为8∶1
B.还原产物为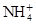
C.若有1 mol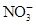 参加还原反应,转移8 mol e-
参加还原反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
参考答案:A
本题解析:分析各粒子的性质判断反应物和生成物,反应物应为Fe2+、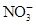 和H+,生成物应为Fe3+、
和H+,生成物应为Fe3+、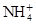 和H2O。运用得失电子守恒,配
和H2O。运用得失电子守恒,配
本题难度:一般
5、填空题 氧化还原反应中实际上包含?氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-?+4H++3e-===NO↑+2H2O KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:? ___________________________________。
(2)反应中硝酸体现了________、________性质。
(3)反应中若产生0.2?mol气体,则转移电子的物质的量是________mol。
(4)若1?mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是____________________________________________________________。
参考答案:(1)14HNO3+3Cu2O=== 6Cu(NO3)2+2
本题解析:
本题难度:一般