微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)利用氧化还原反应原理配平以下化学方程式,并:
FeSO4 + KNO3 + H2SO4 === K2SO4 + Fe2(SO4)3 + NO↑+ H2O
(1)标出电子转移的方向和数目K^S*5U.C#O
(2)当电子转移了0.3mol时,有 g氧化剂参加反应
参考答案:
 本题解析:略
本题解析:略
本题难度:简单
2、选择题 用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)???△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)???△H=-1160kJ/mol
下列说法正确的是
A.若用标准状况下4.48LCH4还原NO2生成N2和水蒸气,放出热量为173.4 kJ/mol
B.由反应①可推知CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H﹥-574kJ/mol
C.反应②中当4.48LCH4反应完全时转移的电子总数为1.60mol
D.反应①②转移的电子数相同
参考答案:D
本题解析:
试题分析:A、①+②得:2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g);ΔH=-1734? kJ/mol-1,将题给数据带入计算,放出热量的数值正确单位错误,错误;B、对比①和选项所给反应生成物水的状态不同,生成液态水放出的热量多,△H越小,错误;C、反应②中没有明确温度和压强,无法计算甲烷的物质的量,无法计算转移的电子数,错误;D、反应①和②中CH4?均被氧化为CO2转移电子数为8,正确。
本题难度:一般
3、填空题 在有机化学工业中常用的一种钠盐是NaBH4,即硼氢化钠。它具有很强的还原性,也是一种高贮氢密度材料,是最有可能作为氢燃料电池的即时供应氢源。但它不能与水和酸共存。
⑴将其投入水中可生成偏硼酸钠(NaBO2)和氢气,写出该反应的化学方程式 ,反应中的还原剂是 ,每摩NaBH4反应时电子转移数为 mol。
⑵若将NaBH4投入酸溶液中其反应速率与其放入水中相比,应快还是慢 ,理由是 。
⑶NaBH4还用于将含Au3+的碱性废液中回收黄金,其离子方程式为:
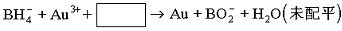
请写出配平的离子方程式 。
参考答案:⑴NaBH4+2H2O=NaBO2+4H2↑ &#
本题解析:略
本题难度:一般
4、选择题 Ag2 Se单晶呈六角微型管状,有望开发为新型材料,其制取原理为:4AgCl+3Se +6NaOH????2Ag2Se+ Na2SeO3+4NaCl+3H2O
关于该反应下列叙述正确的是?????????????????(???)
A.AgCl作氧化剂
B.6mol NaOH参加反应转移6mol e-
C.被还原硒与被氧化硒的质量比为1:2
D.被还原硒与被氧化硒的物质的量之比为2:1
参考答案:D
本题解析:
试题分析:A、AgCl化合价没有发生变化,不是氧化剂、还原剂,故错;B、6mol NaOH参加反应转移的是4mol e-,故错;C、被还原硒与被氧化硒的质量比为2:1,故错。故选D。
点评:本题考查氧化还原反应的特征和有关的概念内涵,要求学生具有分析和解决问题的能力,注意反应中只有一种元素化合价变化时的情况,难度较大。
本题难度:一般
5、选择题 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO。下列叙述正确的是?
Si3N4+6CO。下列叙述正确的是?
A.Si3N4的摩尔质量是154g
B.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂
C.Si3N4既是氧化产物,又是还原产物
D.1molSiO2发生反应,N2得到4mol电子
参考答案:D
本题解析:
试题分析:A.摩尔质量的单位是g/mol.错误。B.在氮化硅的合成反应中,N2中的N元素的化合价降低,得到电子,是氧化剂,而单质C中的C元素的化合价升高,失去电子,是还原剂。错误。C.由于在反应中N2→Si3N4,N元素的化合价降低得到电子。而Si的化合价没有变化,所以Si3N4是还原产物。错误。D.由方程式可以看出若有3mol的SiO2发生反应。转移电子12mol.因此1molSiO2发生反应,N2得到4mol电子。正确。
本题难度:简单