微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温时,将一定量的醋酸和氢氧化钠溶液混合,充分反应后,对于所得溶液的叙述一定正确的是
A.若pH < 7 ,则c (CH3COO -)>c(Na +)>c( H + )>c (OH -)
B.若pH =7,且V(酸)=V(碱),则c( 酸)>c(碱)
C.若pH > 7,且V(酸)=V(碱),则c( 酸)< c(碱)
D.无论溶液的酸碱性如何,溶液中均只含有下列微粒:CH3COO-、Na+、H+、OH- CH3COOH
参考答案:B
本题解析:A 错误,若pH < 7,也可能出现:c (CH3COO -)>c( H + )>c(Na +)>c (OH -)
B 正确,若pH =7,显中性,醋酸是弱酸,氢氧化钠是强碱,且V(酸)=V(碱),只有c( 酸)>c(碱)才成立。
C 错误,若pH > 7,且V(酸)=V(碱),则c( 酸)= c(碱)也成立
D 错误,溶液中还存在H2O分子。
本题难度:一般
2、选择题 下列说法不正确的是(??? )
A.pH=7的溶液可能呈碱性
B.pH=6的溶液中c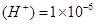
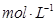
C.pH=6的溶液中c
D.室温下,任何物质的水溶液中都有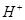 和
和 且K
且K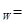 c
c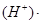 c
c
参考答案:C
本题解析:
试题分析:A.温度不同,水的离子积常数不同,则划分溶液酸碱性的pH值不同,如100 0C时,水的离子积为1?10-12,纯水的pH=6呈中性,pH=7的溶液呈碱性。所以A正确。
B. pH ="-lg" c(H+),pH=6,即c(H+)=1?10-6mol/L。正确。
C. pH=6的溶液中:c(OH-)=KW? c(H+),由于温度不确定,则KW值不确定,c(OH-)无法计算。C错误。
D.是水的离子积的概念,正确。
点评:理解水的离子积常数的意义和注意事项(在同一温度
本题难度:一般
3、选择题 某温度下,重水(D2O)的离子积常数为1.6×10-15?若用定义pH一样来规定
pD=-lg(D+),则在该温度下,下列叙述正确的是(??)。
A??纯净的重水中,pD="7?????"
B?? 1 L溶解有0.01 mol DC1的重水溶液,其pD=2
C?? 1 L溶解有0.01 mol NaOD的重水溶液,其pD=12
D??纯净的重水中, C(D+)C(OD-)>1.0×10-1 4?
参考答案:B
本题解析:略
本题难度:一般
4、实验题 (8分)50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
 ?
?
(1)从实验装置上看,有两处缺点,其一是有处错误安装会导致热量散失较大,应该改正为????????? ,其二尚缺少一种玻璃仪器,这玻璃仪器名称是???????????
(2)烧杯间填满碎纸条的作用是?????????????????。
(3)若大烧杯上不盖硬纸板,求得的反应热数值??????????(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量??????(填“相等”或“不相等”),所求中和热????????(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会
???????(填“偏大”、“偏小”或“无影响”)。
(6)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为2.2℃ 2.4℃ 3.4℃,则最终代入计算式的温差均值为???℃
参考答案:(1)小烧杯和大烧杯的杯口应相平、环形玻璃搅拌棒
(2
本题解析:(1)根据装置图可知,小烧杯和大烧杯的杯口没有相平,会导致热量损失。实验中需要搅拌,所以还缺少环形玻璃搅拌棒。
(2)该实验要尽可能的减少热量的损失,所以烧杯间填满碎纸条的作用是保温(或隔热、或减少热损失)。
(3)若大烧杯上不盖硬纸板,热量会损失,因此求得的反应热数值偏小。
(4)改变酸或碱的用量,放出的热量会变化,但中和热是不变的,因为中和热是稀溶液中酸和碱作用生成1mol水时反应所放出的热量。
(5)氨水是弱碱,存在电离平衡。由于电离是吸热的,所以测得的中和热数值会偏小。
本题难度:一般
5、选择题 已知火箭燃料二甲基肼(CH3—NH—NH—CH3)的燃烧热为-6 000 kJ·mol-1,则30 g二甲基肼完全燃烧放出的热量为
A.3000 kJ
B.1500 KJ
C.6 000 kJ
D.12 000 kJ
参考答案:A
本题解析:
试题解析:二甲基肼的相对分子质量是 60 g/mol,则30g 二甲基肼是 0.5 mol, 放出的热量是燃烧热的一半,即 3 000 kJ。
考点: 有关反应热的计算
本题难度:一般