微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温时,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为
A.V(酸)=102V(碱)
B.V(碱)=102V(酸)
C.V(酸)=2V(碱)
D.V(碱)=2V(酸)
参考答案:B
本题解析:
试题分析:根据溶液的PH分别计算溶液中c(H+)和c(OH-),酸碱溶液混合pH=7,则说明n(H+)=n(OH-),以此进行计算,强酸溶液pH=a,则c(H+)=10-amol/L,强碱溶液pH=b,则c(OH-)=10b-14mol/L,酸碱溶液混合pH=7,则说明n(H+)=n(OH-),则有:V(酸)×10-amol/L=V(碱)×10b-14mol/L,答:碱溶液体积V(碱)和酸溶液体积V(酸)的关系为V(碱)=102V(酸)
点评:考查酸碱混合的计算,
本题难度:简单
2、选择题 25 ℃时,在浓度均为0.01 mol·L-1的NaCN与HCN组成的混合溶液中,测得c(Na+)>c(CN-),则下列描述中不正确的是( )
A.该溶液的pH<7
B.CN-的水解程度大于HCN的电离程度
C.c(CN-)+c(HCN)=0.02 mol·L-1
D.c(CN-)+c(OH-)=0.01 mol·L-1+c(H+)
参考答案:A
本题解析:由电荷守恒及c(Na+)>c(CN-)可知,c(H+)<c(OH-),pH>7,A错误;由题意知CN-的水解程度大于HCN的电离程度,B正确;由物料守恒及电荷守恒知,c(CN-)+c(HCN)=0.02 mol·L-1,c(CN-)+c(OH-)=0.01 mol·L-1+c(H+),故C、D正确。
本题难度:一般
3、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH="+49.0" kJ·mol-1
CO2(g)+3H2(g) ΔH="+49.0" kJ·mol-1
②CH3OH(g)+O2(g) CO2(g)+2H2(g) ΔH="-192.9" kJ·mol-1
CO2(g)+2H2(g) ΔH="-192.9" kJ·mol-1
下列说法正确的是( )
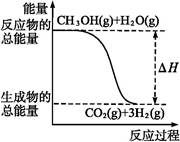
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+O2(g) CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
参考答案:D
本题解析:反应②中H2(g)不是稳定的氧化物,A项不正确;反应①为吸热反应,而图示反应为放热反应,B项不正确;据题给反应①、②可知,CH3OH转变成H2的过程可以吸收能量,也可以放出能量,C项不正确;由于CH3OH在气态时比在液态时能量高,可知等量CH3OH(l)比CH3OH(g)反应时放出热量少,即D项正确。
本题难度:简单
4、选择题 化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.天然气、石油、流水、风力、氢气为一级能源
B.无论是风力发电还是火力发电,都是将化学能转化为电能
C.PM 2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
D.发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统
参考答案:D
本题解析:
试题分析:A、一级能源是指直接从自然界取得的能源,氢气不属于一级能源;B、风力发电是将风能转化为电能;C、砷元素属于非金属元素;D、低碳经济、循环经济,利用太阳能、风能均有利于能源开发和环境保护,正确。
本题难度:简单
5、填空题 (10分)
(1)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液
(假设无损失),
①__?????和_??????两种粒子的物质的量之和等于0.1mol。
②_??????和_??????两种粒子的物质的量之和比OH―多0.05mol。
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中
各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是?????????,上述离子浓度大小
顺序关系中正确的是(选填序号)????????????????。
②若上述关系中C是正确的,则溶液中溶质的化学式是????????????。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl)????????c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后
溶液中c(NH4+)与c(Cl-)的关系c(NH4+)???????????c(Cl-)
参考答案:(10分)(1)①NH3?H2O和NH4+②NH4+和H+<
本题解析:(1)溶液混合问题,首先考虑是否反应。此题中,NH4Cl与NaOH反应,生成0.05molNaCl和0.05mol NH3·H2O,另外还剩余0.05mol NH4Cl。根据N原子守恒,NH3?H2O和NH4+之和为0.1mol。根据电荷守恒n(Na+)+ n(H+)+ n(NH4+)=n(Cl-)+ n(OH-),可以得到n(H+)+ n(NH4+)- n(OH-)= n(Cl-)- n(Na+)=0.1mol-0.05mol=0.05mol。
(2)任何水溶液中均存在OH-和H+,所以去掉OH-
本题难度:一般