微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列变化为放热的化学反应的是( )
A.H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/mol
C.形成化学键时共放出862 kJ能量的化学反应
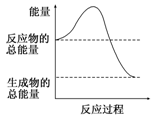
D.能量变化如图所示的化学反应
参考答案:D
本题解析:选项A不是化学变化,不正确;选项B是吸热反应;形成化学键一定是放热的,但相应的化学反应不一定是放热反应,选项C不正确;根据图像可知,反应物的总能量高于生成物的总能量,所以反应是放热反应,答案选D。
本题难度:一般
2、选择题 在同温同压下,下列各组热化学方程式Q2>Q1的是( )
A.2H2(g) + O2(g)=2H2O(l);△H=-Q1 2H2(g) + O2(g)=2H2O(g);△H=-Q2
B.S(g) + O2(g)=SO2(g);△H=-Q1 S(s) + O2(g)=SO2(g);△H=-Q2
C. C(s) + O2(g)=CO2(g);△H=-Q2
C(s) + O2(g)=CO2(g);△H=-Q2
D.H2(g) + Cl2(g)=2HCl(g);△H=-Q1
参考答案:C
本题解析:
试题分析:反应放出或吸收的热量的多少,跟反应物和生成物的聚集状态有密切关系。A中两式仅生成物中水的状态不同,由于生成液态水比生成气态水放热多,所以Q1>Q2;B中两式仅硫的状态不同,由于固态硫变成气态硫要吸收热量,所以Q1>Q2;C中固态碳与氧气完全反应生成二氧化碳,放出的热量Q2应大于不完全燃烧时生成一氧化碳放出的热量Q1;D中二式各物质的量不同,有Q1=2Q2的关系,故本题的答案应为C。
考点:考查反应热的有关判断
点评:该是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力和方法的培养与训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确影响反应热大小的因素,然后结合题意灵活运用即可。
本题难度:简单
3、选择题 下列说法正确的是( )
A.化学键断裂放出能量
B.离子化合物中可能含有共价键
C.单质中可能含离子键
D.由分子组成的物质中一定存在共价键
参考答案:A、化学键的断裂吸收能量,化学键的形成放出能量,故A错误;<
本题解析:
本题难度:一般
4、填空题 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15 kJ,则CH4燃烧的热化学方程式是 。
(2)已知:C(s) + O2(g)  CO2(g) ΔH=-437.3 kJ?mol-1
CO2(g) ΔH=-437.3 kJ?mol-1
H2(g) + 1/2 O2(g)  H2O(g) ΔH=-285.8 kJ?mol-1
H2O(g) ΔH=-285.8 kJ?mol-1
CO(g) + 1/2 O2(g)  CO2(g) ΔH=-283.0 kJ?mol-1
CO2(g) ΔH=-283.0 kJ?mol-1
则煤的气化主要反应的热化学方程式是:C(s) + H2O(g)  CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键
| H-H
| N-H
| N≡N
|
键能/kJ·mol-1
| 436
| 391
| 945
已知反应N2+3H2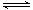 2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为 。 2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为 。
参考答案:(3)-93
本题解析:
试题分析:(1)在25 ℃、101 kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15 kJ,则1molCH4在氧气中燃烧生成CO2和液态水,放出889kJ热量,热化学方程式为:
CH4(g)+2O2(g)
本题难度:一般
5、选择题 单质X和Y相互反应生成X2+Y2-.下列叙述中不正确的是
A.X被氧化
B.X是氧化剂
C.X2+具有氧化性
D.Y的氧化性比X2+的氧化性强
参考答案:B
本题解析:分析:单质X和Y相互反应生成X2+Y2-,可知X化合价升高,被氧化,Y化合价降低,被还原,以此解答该题.
解答:A.X化合价升高,被氧化,故A正确;
B.X被氧化,应为还原剂,故B错误;
C.X2+中化合价为较高价态,具有氧化性,故C正确;
D.根据氧化剂氧化性大于氧化产物氧化性可知Y的氧化性比X2+的氧化性强,故D正确.
故选B.
点评:本题考查氧化还原反应,题目难度不大,注意把握元素化合价的变化,从化合价的角度认识氧化还原反应的相关概念.
本题难度:简单
|