微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中不正确的是
A.与煤油、柴油相比较,天然气是一种比较清洁的化石燃料
B.乙醇是一种可再生能源,作为燃料的优点的是完全燃烧的产物不污染环境
C.利用太阳能、风能和氢能等能源替代化石能源能有效改善空气质量
D.煤的气化和液化不仅可以获得洁净燃料,而且再燃烧会放出更多的热量
参考答案:D
本题解析:
试题分析:天然气的主要成分是甲烷,完全燃烧的生成物是CO2和水,属于清洁燃料,选项A正确;乙醇属于可再生能源,其燃烧产物是水和CO2,不会造成环境污染,选项B正确;太阳能、风能和氢能等均是新能源,不会造成环境污染,替代化石能源能有效改善空气质量,选项C正确;根据能量守恒定律可知,煤的气化和液化可以获得洁净燃料,但再燃烧不会放出更多的热量,选项D不正确,答案选D。
点评:化学与可持续发展及环境保护尽管不是教学的重点,但该内容与我们的生产、生活息息相关,因此成为历年高考的必考的热点。试题的命题形
本题难度:一般
2、选择题 已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A.HF与CaCl2反应产生沉淀
B.25℃时0.2mol·L-1HF溶液中pH=2
C.Ksp(CaF2)随温度和浓度的变化而变化
D.该体系中最终没有氟化氢分子
参考答案:A
本题解析:混合后氟离子和钙离子的浓度分别是6×10-3mol/L和0.1mol/L,此时c(F-)2·c(Ca2+)=3.6×10-5>.46×10-10,所以能产生沉淀,A正确。25℃时0.2mol·L-1HF溶液中氢离子浓度是8.5×10-3mol/L,B不正确。溶度积常数只与温度有关系,C不正确。氟化氢是弱电解质,始终存在电离平衡,即溶液中一定含有氟化氢分子,D不正确,答案选A。
本题难度:一般
3、实验题 (8分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)他们记录的实验数据如下:
实验用品
| 溶液温度
| 中和热△H
|
t1
| t2
|
①
| 50mL0.55mol.L-1NaOH
| 50mL.0.5mol.L-1HCl
| 20℃
| 23.3℃
|
|
②
| 50mL0.55mol.L-1NaOH
| 50mL.0.5mol.L-1HCl
| 20℃
| 23.5℃
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
计算完成上表。△H=
(3)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
研究小组做该实验时环境温度 (填“高于”、“低于”或“等于”)22 ℃,此反应所用NaOH溶液的浓度应为 mol/L。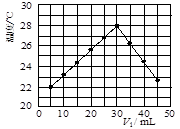
参考答案:(1)量筒、温度计。(2)-56.8KJ/mol(3)低于,
本题解析:中和热的测定实验一定要采取各种措施减小热量的损失以减少误差,一般用多次测量求平均值的方法来进行测定。
(2)Q=Cm(t2 -t1)=1.42kJ,而△H=—1.42/(0.05×0.5)=—56.8kJ/mol
(3)由图看出,HCl溶液体积为5ml中和后的溶液温度为22℃,所以室温应该低于22℃
当 HCl溶液为30ml,NaOH溶液为20ml时两者恰好反应。由C1V1=C2V2可计算NaOH溶液的浓度为1.5mol/L
本题难度:一般
4、选择题 室温时,向10mL的醋酸稀溶液中逐滴滴入NaOH稀溶液至过量,有关叙述正确的是
A.实验过程中水的电离程度的变化是先减小后增大
B.当溶液呈中性时,反应恰好完全
C.当反应恰好完全时,消耗NaOH溶液10mL
D.当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+)
参考答案:D
本题解析:
试题分析:当氢氧化钠过量时,抑制水的电离,A不正确;醋酸和氢氧化钠恰好反应时,生成的醋酸钠水解,溶液显碱性,B不正确;由于不能确定水解溶液的浓度,因此不能确定消耗氢氧化钠溶液的体积,C不正确;D中符合电荷守恒,正确,答案选D。
点评:该题属于基础性试题,难度不大。重点考查外界条件对水的电离平衡的影响。溶液中离子浓度大小比较。在比较溶液中离子浓度大小时,关键是利用好几个守恒关系,即电荷守恒、物料守恒和质子守恒。
本题难度:一般
5、选择题 下列说法不正确的是
A.电能是现代社会中应用最广泛、使用最方便、污染最小的一种能源
B.酶比其他催化剂有更高的选择性和催化效率,因此“仿酶催化”是化学研究的一个重要主题
C.将煤制成煤气,可以提高燃烧效率
D.增加炼铁高炉的高度,使CO与氧化铁充分反应,可以消除高炉尾气中的CO
参考答案:D
本题解析:略
本题难度:简单
|