微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应4NH3(g)+ 5O2(g) 4NO(g)+6H2O(g),在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3?mol,则此反应的平均速率为 [???? ]
4NO(g)+6H2O(g),在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3?mol,则此反应的平均速率为 [???? ]
A.v(O2)=0.01mol/(L s) ????
s) ????
B.v(NO)=0.008mol/(L s) ????
s) ????
C.v(H2O)=0.003mol/(L s) ????
s) ????
D.v(NH3)=0.004mol/(L s)
s)
参考答案:C
本题解析:
本题难度:简单
2、填空题 合成氨尿素工业生产过程中涉及的物质转化过程如下图所示。
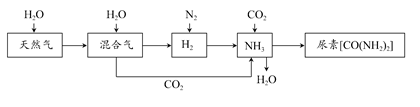
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为___________________________________。
(2)在合成氨生产中,将生成的氨气及时从反应后的气体中分离出来。运用化学平衡的知识分析这样做是否有利于氨的合成,说明理由:___________。
(3)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。
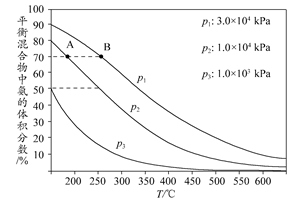
①若分别用vA(NH3)和vB(NH3)表示从反应开始至平衡状态A、B时的化学反应速率,则vA(NH3)________vB(NH3)(填“>”、“<”或“=”)。
②在相同温度下,当压强由p1变为p3时,合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
③在250°C、1.0×104kPa下,H2的转化率为________%(计算结果保留小数点后1位)。
参考答案:(1)CH4+H2O(g) 本题解析:(1)由原子守恒可写出:CH4+H2O(g)
本题解析:(1)由原子守恒可写出:CH4+H2O(g) CO+3H2。(2)从反应体系中移走氨气,减小了生成物浓度,平衡向右移动,利于NH3生成。(3)化学平衡常数只和温度有关,改变压强,化学平衡常数不变。由图示可知250°C、1.0×104 kPa时,平衡混合物中NH3占50%,设N2的转化量为x,则:
CO+3H2。(2)从反应体系中移走氨气,减小了生成物浓度,平衡向右移动,利于NH3生成。(3)化学平衡常数只和温度有关,改变压强,化学平衡常数不变。由图示可知250°C、1.0×104 kPa时,平衡混合物中NH3占50%,设N2的转化量为x,则:
N2 + 3H2 2NH3
2NH3
起始:? 1?????? 3????? 0
转化:? x?????? 3x???? 2x
平衡:? 1-x? 3-3x? 2x
即: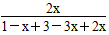 ×100%=50%,解得x=2/3,
×100%=50%,解得x=2/3,
故a(H2)= ×100%≈66.7%。
×100%≈66.7%。
本题难度:一般
3、填空题 N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在恒容密闭容器中N2O5可发生下列反应: 2N2O5(g) ≒ 4NO2(g) + O2(g).△H﹥0
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将________(填“增大”、“减小”、“不变”)。
(2)下表为反应在T1温度下的部分实验数据:
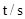
| 0
| 500
| 1000
|
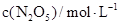
| 5.00
| 3.52
| 2.48
则,500s内N2O5的分解速率为_______________。
(3)在T2温度下,反应1000 s时测得NO2的浓度为4.98mol·L-1。则T2 __________ T1。(填“大于”“等于”或“小于”)
参考答案:(1) 不变.???? (2) 2.96×10-3mol/(
本题解析:(1)加入氮气,但不能改变反应物和生成物的浓度,因此平衡不移动,N2O5的转化率不变。
(2)500s内N2O5的浓度减少了(5.00-3.52)mol/L,所以其反应速率是1.48mol/L÷500s= 2.96×10-3mol/(L.S)。
(3)正反应是吸热反应,所以升高温度,平衡向正反应方向进行,NO2的浓度增大。但在温度为T1时,NO2的浓度是5.04mol/L,这说明T2小于T1。
本题难度:一般
4、选择题 在密闭容器中,发生反应H2 (g)+ I2 (g)  2HI(g),通入xmol H2和ymol I2 蒸气,当x=2,y=1时在一密闭容器中某温度条件下反应达到平衡时碘的转化率为10%,,则该温度条件下平衡常数K= ????????????。 2HI(g),通入xmol H2和ymol I2 蒸气,当x=2,y=1时在一密闭容器中某温度条件下反应达到平衡时碘的转化率为10%,,则该温度条件下平衡常数K= ????????????。
参考答案:0.023
本题解析:本题考查化学平衡的计算。
H2 (g)+ I2 (g)  2HI(g) 2HI(g)
起始量: 2???? 1???????? 0
转化量: 0.1??? 0.1?????? 0.2
平衡量:1.9???? 0.9?????? 0.2
平衡常数K=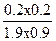 =0.023。 =0.023。
本题难度:一般
5、填空题 向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:N2(g)+3H2(g)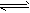 2NH3(g),平衡时混合气共7 mol。令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变。则: 2NH3(g),平衡时混合气共7 mol。令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变。则:
(1)若a=0,b=0,则c=_______
(2)若a=0.7,b=2.1,则:
①c=_______
②这时反应向_______进行,因为:______________
③若要维持反应开始向该反应方向进行,c的范围是_______
(3)欲使起始反应维持向与②相反的方向进行,则b的范围是______________
参考答案:(1)4
(2)①2.6;②逆反应方向;浓度商>平衡常
本题解析:
本题难度:一般
|