微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 芬兰籍华人科学家张霞昌研制的“超薄型软电池”获2009年中国科技创业大赛最高奖,被称之为“软电池”的纸质电池总反应为:Zn+2MnO2+H2O = ZnO+2MnOOH。下列说法正确的是 [???? ]
A.该电池中Zn作负极,发生还原反应
B.该电池反应中MnO2起催化作用
C.该电池工作时电流由Zn经导线流向MnO2
D.该电池正极反应式为:2MnO2+2e-+2H2O = 2MnOOH +2OH-
参考答案:D
本题解析:
本题难度:一般
2、填空题 (选考)【化学—选修2:化学与技术】(15分)
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 ;用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
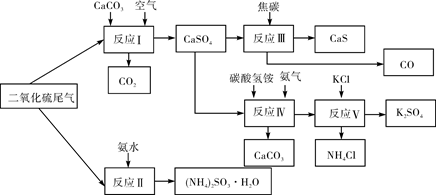
① 生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
② 下列有关说法正确的是 (填序号)。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C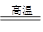 CaS+4CO↑
CaS+4CO↑
C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
③ 反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
参考答案:(1) 负(2分) SO2+2H2O
本题解析:
试题分析:(1)根据方程式可知SO2被氧气氧化为三氧化硫,原电池中负极失去电子,则实际过程中,将SO2通入电池的负极,电极反应式为SO2+2H2O-2e-=SO42-+4H+。根据以上分析可知其优点是利用上述电池,可回收大量有效能,副产品为H2SO4,减少环境污染,实现(能质)共生。
(2)①反应Ⅱ中生成亚硫酸铵,而亚硫酸铵易被氧化生成硫酸铵,因此加入还原性很强的苯二酚等物质能防止亚硫酸铵被氧化。
②A.为提高SO2的转化率,反应I中需要鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙,A正确;B.根据流程图可知在高温下焦炭与硫酸钙反应生成CaS和CO,则反应III中发生反应的化学方程式为CaSO4+4C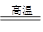 CaS+4CO↑,B正确;C.碳酸氢铵是弱酸的铵盐,受热易分解,所以反应IV需控制在60~70℃的目的之一是减少碳酸氢铵的分解,C正确;D.反应V中的副产物氯化铵可用作氮肥,D正确,答案选ABCD。
CaS+4CO↑,B正确;C.碳酸氢铵是弱酸的铵盐,受热易分解,所以反应IV需控制在60~70℃的目的之一是减少碳酸氢铵的分解,C正确;D.反应V中的副产物氯化铵可用作氮肥,D正确,答案选ABCD。
③由于K2SO4在有机溶剂乙二醇中溶解度小,选用有机溶剂做溶剂有利于硫酸钾能充分析出。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,这说明亚硫酸铵是还原剂。由于同时生成一种氮肥,因此该氮肥是硫酸铵,则反应的离子方程式为4(NH4)2SO3+2NO2=4(NH4)2SO4+N2。
考点:考查化学与技术模块的有关分析与应用
本题难度:困难
3、填空题 某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性.
(1)D装置中电解饱和食盐水的离子反应方程式为:______
(2)为检验氯气的氧化性,则E装置的溶液可以是______.
A.淀粉碘化钾溶液??B.酸性KMnO4溶液????C.FeCl2溶液????D.Na2S溶液
(3)F装置的目的是______.
(4)为测定Cu的相对原子质量,某同学设计了如下的方案:
精确测量硬质玻璃管的质量为a?g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b?g,实验完毕后(通过足量的氢气),通过精确测量硬质玻璃管和Cu粉的总质量为c?g,进而确定Cu的相对原子质量.
①对B装置中的氧化铜粉末加热前,需要进行的操作为______;
②A装置中盛放的试剂为______;
③根据测得结果进行计算,则Cu的相对原子质量为______.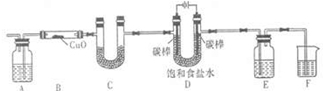
参考答案:(1)D装置中电解饱和食盐水生成氢氧化钠、氯气、氢气,反应离
本题解析:
本题难度:一般
4、选择题 将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
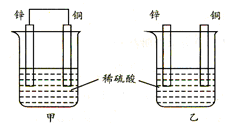
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极, 电极反应:Zn-2e→Zn2+
C.两烧杯中的pH值均增大
D.产生的气泡速率甲比乙慢
参考答案:C
本题解析:
试题分析:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;B.乙中不构成原电池,铜片不是电极,故B错误;C.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,溶液的pH值都增大,故C正确;D.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D错误;故选C.
本题难度:一般
5、填空题 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,b电极变粗,且在c、d电极有气体产生,两极上共收集到336mL(标准状态)气体.回答:
(1)直流电源中,M为______极.
(2)Pt电极上生成的物质是______,其质量为______g.
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2:______:______:______.
(4)AgNO3溶液的浓度______(填“增大”、“减小”或“不变”.下同),AgNO3溶液的pH______,H2SO4溶液的浓度______,H2SO4溶液的pH______.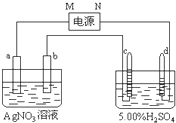
参考答案:(1)根据题意知,电极a、b上没有气体生成,则a作阳极,b为
本题解析:
本题难度:一般