微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在0.1 mol·L-1Na2CO3溶液中,下列关系正确的是????????????????????????????????(???)
A.c(Na+)>c(CO32一)>c(OH一)>c(HCO3一)>c(H+)
B.c(Na+)+c(H+)=c(HCO3一)+c(CO32-)+c(OH一)
C.c(Na+)>c(CO32一)>c(HCO3-)>c(H+)>c(OH一)
D.c(HCO3一)+2c(CO32一)+c(H2CO3)="0.1" mol·L-1
参考答案:A
本题解析:略
本题难度:简单
2、填空题 物质A~E都是由下表中的离子组成的,常温下将各物质的溶
液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。请回答下列问题。
阳离子
| NH4+、H+、Na+
|
阴离子
| OH-、CH3COO-、Cl-
?
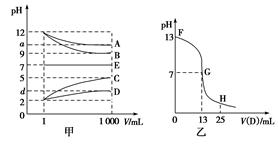
(1)根据pH的变化关系,写出物质的化学式:B?????,C???????。
(2)写出A与C反应的离子方程式:???????????。
(3)图乙为室温时向25 mL某浓度的B溶液中逐滴滴加0.2 mol·L-1的D溶液的过程中pH的变化曲线。
①图乙中B的物质的量浓度为???????mol·L-1。
②G点溶液呈中性,则二者恰好完全反应的点是在FG区间还是GH区间????????区间。
③FG区间溶液中各离子浓度大小关系是???????????。
(4)t ℃时,A的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=13,该温度下(t ℃),将100 mL 0.2 mol·L-1的C溶液与100 mL 0.4 mol·L-1的B溶液混合后(溶液体积变化忽略不计),溶液的pH=???????。
参考答案:(1)NaOH HCl
(2)NH3·H2O+H+=N
本题解析:根据各物质的溶液从1 mL稀释到1 000 mL,pH的变化图象知,B和C溶液的pH变化为3,A和D溶液的pH变化小于3,则B为强碱,A为弱碱或强碱弱酸盐,C为强酸,D为弱酸或强酸弱碱盐,可先确定B为NaOH,C为HCl。结合A与D反应得到E,而E的pH不变,则E可能是NaCl或醋酸铵,结合B为NaOH,C为HCl,则推出E只能为醋酸铵,所以A为NH3·H2O,B为NaOH,C为HCl,D为CH3COOH。向NaOH溶液中滴加醋酸,起点pH=13,NaOH的浓度为0.1 mol·L-1。二者恰好完全反应生
本题难度:一般
3、选择题 下列离子因水解相互促进而不能共存的是()
A.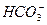 、Na+、Cl-、OH- 、Na+、Cl-、OH-
B.Al3+、Na+、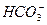 、 、
C.H+、Fe2+、 、Cl- 、Cl-
D.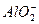 、K+、 、K+、 、Al3+ 、Al3+
参考答案:BD
本题解析:解决本题的关键是判断溶液中是否同时存在弱酸的酸根和弱碱的阳离子。A选项中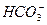 与OH-因发生复分解反应不能大量共存。B选项中Al3+与 与OH-因发生复分解反应不能大量共存。B选项中Al3+与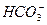 本题难度:简单 本题难度:简单
4、简答题 10℃时,在烧杯中加入0.1mol/L的?NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 50 | 70
pH
8.3
8.4
8.5
8.9
9.4
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为______;
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
______(填“大于”或“小于”)NaHCO3;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH______8.3(填“>”、“<”或“=”),说明甲正确,若pH______8.3(填“>”、“<”或“=”),说明乙正确;
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明______(填“甲”或“乙”)推测正确;
(5)将一定体积0.1mol/L的?NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1.据此资料可以判断______(填“甲”或“乙”)推测正确,原因是______.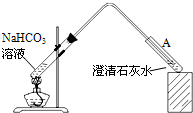
参考答案:(1)碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性,水解方
本题解析:
本题难度:一般
5、选择题 己知H2CO3的酸性强于H2S,将amol·L -1 NaHS与bmol·L-1NaOH两种稀溶液等体积混合(a>0,b>0),所得溶液中微粒间的物质的量浓度关系正确的是
A.a=b时:c(OH-)= c(H+)+c(HS-)
B.a=2b时:c(S2-)>c(HS )>c(OH-)>c(H+)
C.a=3b时:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
D.a=4b时:4c(Na+)=5c(S2-)+5c(HS-)5c(H2S)
参考答案:CD
本题解析:
试题分析:A、当两者等量混合时,溶质为Na2S,其质子守恒方程式为:c(OH-)= c(H+)+c(HS-)+2c(H2S),错误;B、当a=2b时,溶质为等物质的量的NaHS和Na2S混合,两者均水解,溶液显碱性,且以S2-的水解为主,故c(HS-)>c(S2-),错误;C、任何溶液中均存在电荷守恒,正确;D、当a=4b时,溶质为3:1的NaHS与Na2S,由物料守恒有:4n(Na)=5n(S),正确。
本题难度:一般
|
|