微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题  在一定温度下,HCN在水中存在电离平衡:HCN
在一定温度下,HCN在水中存在电离平衡:HCN H+ + CN-。下列说法错误的
H+ + CN-。下列说法错误的
 通入HCl气体,Q>K,平衡逆向移动
通入HCl气体,Q>K,平衡逆向移动
升高温度,溶液pH减小
 稀释溶液,电离平衡常数减小
稀释溶液,电离平衡常数减小
D.加入NaCN固体,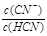 增大
增大
参考答案:C
本题解析:
答案:C
A、正确,通入HCl气体,H+浓度增大,平衡逆向移动;
B、正确,电离是吸热反应,升高温度,平衡正向移动,H+浓度增大,溶液pH减小
C、不正确,稀释溶液,电离平衡常数不变;
D、正确,CN―浓度增大的幅度大于HCN。
本题难度:简单
2、选择题 25℃时,有下列四种溶液:
①
| ②
| ③
| ④
|
0.1 mol·L-1氨水
| pH=11氨水
| 0.1 mol·L-1盐酸
| pH=3盐酸
?
下列说法正确的是
A.①稀释到原来的100倍后,pH与②相同
B.等体积①③混合、等体积②④混合所得的溶液都呈酸性
C.①②中分别加入少量CH3COONa固体, 的值都变小 的值都变小
D.将20mL的①溶液与10mL的③溶液混合后,若溶液呈碱性,则:c(NH4+) >c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
参考答案:D
本题解析:
试题分析:A、氨水是弱电解质,存在电离平衡,稀释100倍,pH值变化小于2,错误;B、等体积①③混合得到氯化铵,水解呈酸性;等体积②④混合得到氯化铵与氨水混合物,氨水电离为主,溶液为碱性,错误;C、加入的CH3COONa固体水解呈碱性,抑制氨水的电离,比值变大,错误;D、溶液为等浓度的氨水和氯化铵溶液混合,存在氨水的电离平衡和铵根离子的水解平衡,根据溶液为碱性,确定以氨水的电离平衡为主,则有c(NH4+) >c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+),正确。
本题难度:一般
3、选择题 室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH- Al(OH)3↓ Al(OH)3↓
B.其溶液的pH=13
C.用适量水稀释后,NH3·H2O电离度和溶液pH都增大
D.加水稀释后,溶液中c(NH4 +)·c(OH-)变小
参考答案:D
本题解析:
试题分析:A.一水合氨是弱碱,不能写成离子形式。其与AlCl3溶液发生反应的离子方程式为Al3++3NH3·H2O= NH4++Al(OH)3↓。错误。B. 一水合氨是弱碱,在溶液中存在电离平衡:NH3·H2O NH4++OH-。c(OH-)<0.10 mol/L,其溶液的pH<13.错误。C.用适量水稀 NH4++OH-。c(OH-)<0.10 mol/L,其溶液的pH<13.错误。C.用适量水稀
本题难度:一般
4、选择题 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中c(CH3COO-)/[c(CH3COOH)··c(OH-)]不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
参考答案:B
本题解析:加水稀释,平衡向正向移动,导电粒子的数目增大,其浓度减少了,A错;温度不变,B项中表达式中上下同乘以c(H+),则表达式变为Ka/Kw,B正确;醋酸的电离程度越大,c(H+)不一定增大,比如加水稀释,C错;从表面上看,加入氢氧化钠溶液,刚好中和,其实醋酸是弱酸,部分电离与氢氧化钠“刚好中和”,醋酸的起始浓度远大于它电离出的c(H+),故醋酸过量,中和后显酸性,D错。答案选B。
本题难度:一般
5、选择题 对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是(?)
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10oC,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用盐酸中和,消耗的盐酸体积相同
参考答案:A
本题解析:同pH,同体积的弱碱和强碱,加入NH4Cl后,氢氧根均减小;温度降低Kw改变,pH改变。加水稀释十倍,氨水电离程度增加,pH(NH3·H2O)>pH(NaOH),n(NH3·H2O)>n(NaOH),NH3·H2O消耗的盐酸更多。
本题难度:一般
|