微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知25 ℃时部分弱电解质的电离平衡常数数据如表所示:

回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a.CH3COONa??????b.Na2CO3??????c.NaClO???????d.NaHCO3
pH由小到大排列顺序是????????(用编号填写)。
(2)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是???。
A.c(H+)
B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数??????????(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是??????????????????????????。

2、选择题 分别在PH=1的酸溶液和PH=14的NaOH溶液中加入足量的铝,放出氢气的量前者多,其原因可能是:①两溶液的体积相同,而酸是多元强酸;②两溶液的体积相同,酸是弱酸;③酸溶液的体积比NaOH溶液体积大;④酸是强酸,且酸溶液的浓度比NaOH溶液浓度大;其中正确的为
A.只有②和③
B.只有②和④
C.只有①和③
D.只有①
3、选择题
(1)在实验过程中水的电离程度的变化趋势是先_______后________;(填“增大”、“减小”或“不变”)
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH,请将表中空格部分填上相应的内容,将表格补充完整。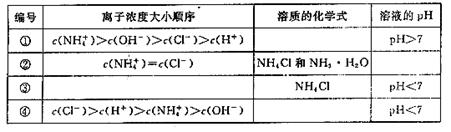
4、选择题 25℃时,0.1mol/L稀醋酸加水稀释,下图坐标中的纵坐标y可以是
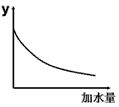
[???? ]
A.溶液的pH
B.醋酸的电离平衡常数
C.溶液的导电能力
D.醋酸的电离程度
5、选择题 物质的量浓度相同的氨水.氢氧化钠和氢氧化钡溶液,分别用蒸馏水稀释到原来的X倍、Y倍、Z倍,稀释后三种溶液的pH同,则X、Y、Z的关系是
[???? ]
A.X=Y=Z
B.X>Y=Z
C.X<Y<Z
D.X=Y<Z