微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有pH=1的盐酸、硫酸、醋酸三瓶溶液(用>、<、=填空,下同).
(1)设三种溶液的物质的量浓度依次为C1、C2、C3,则其关系是______.
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=3,需水的体积依次为V1、V2、V3,则其关系是______.
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是______.
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是______.
参考答案:(1)氯化氢和硫酸是强电解质,则盐酸溶液中C(H+)=C(H
本题解析:
本题难度:一般
2、选择题 25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: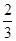 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):
2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
参考答案:AC
本题解析:
试题分析:A、0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积恰好反应混合生成醋酸和氯化钠,醋酸电离溶液显酸性,则c(Na+)=c(Cl-)>cCH3COO-)>c(OH-),A正确;B、0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7),这说明溶液显碱性,因此氨水的电离程度大于铵根的水解程度,则c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-),B不正确;C、0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合,则根据物料
本题难度:一般
3、选择题 氨水中有下列平衡NH3·H2O  NH4++OH- ,当其他条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是(?)
NH4++OH- ,当其他条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是(?)
A.加NaOH 固体
B.加浓HCl
C.加NH4Cl固体
D.加同浓度的氨水
参考答案:C
本题解析:
试题分析:A.加入氢氧化钠,氢氧根离子浓度增大,平衡左移,俺哥们离子浓度减小,故A不符合;B.加入盐酸,促进电离正向进行,铵根离子浓度增大,故B不符合;C.加入氯化铵,铵根离子浓度增大,平衡左移,故C符合;D.加入同浓度氨水,平衡不动,铵根离子浓度不变,故D不符合;故选C。
本题难度:一般
4、实验题 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、???????和???????。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号
| 1
| 2
| 3
| 4
|
消耗NaOH溶液的体积(mL)
| 20.05
| 20.00
| 18.80
| 19.95
?
则该醋酸溶液的准确浓度为???????(保留小数点后四位)。
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L-1)
| 0.001 0
| 0.010 0
| 0.020 0
| 0.100 0
| 0.200 0
| pH
| 3.88
| 3.38
| 3.23
| 2.88
| 2.73
?
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:????????????????????????????????????????????????。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将???????(填“增大”“减小”或“不变”)。
实验三:探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:
???????????????????????????????????????????????????????????????????????。
参考答案:实验一
(1)胶头滴管 250 mL容量瓶
(2
本题解析:实验一:(1)还缺少配制溶液所需的容器250 mL的容量瓶和定容仪器胶头滴管。
(2)首先分析NaOH的体积,第3次数据显然误差较大,舍去。另外三次所用NaOH平均体积为20.00 mL,代入计算可知醋酸的浓度为0.200 0 mol·L-1。
实验二:(1)孤立的看每次测量值,H+浓度远小于醋酸的浓度,说明醋酸不完全电离;联系起来看,浓度为0.100 0 mol·L-1、0.010 0 mol·L-1及0.001 0 mol·L-1的醋酸,pH变化值小于1。
(2)以0.100 0 m
本题难度:一般
5、选择题 下列说法正确的是
A.用乙醇或CCl4可提取碘水中的碘单质
B.NaCl溶液能导电是因为溶液中有自由移动的Na+ 和Cl-
C.H2SO4在电流作用下在水中电离出H+和SO42-
D.液态HCl,固态NaCl均不导电,所以HCl、NaCl都不是电解质
参考答案:B
本题解析:略
本题难度:简单
|
|