微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把4mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+2B(s)  xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是(????? )
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是(????? )
A.A的平均反应速率为0.15 mol?L-1?min-1
B.平衡时,C的浓度为0.25mol?L-1
C.B的平均反应速率为0.1 mol?L-1?min-1
D.平衡时,容器内压强为原来的0.875倍
参考答案:C
本题解析:
试题分析:A.V(A):V(D)="3:1." V(D)=" 0.05mol/(" L?min),所以V(A)=" 0.15mol/(" L?min).正确。B.由于反应是在恒容的密闭容器内进行,达到平衡容器内压强变小,所以3>x+1.因此x="1." V(C):V(D)=1:1,故V(C)=" 0.05mol/(" L?min)。c(C)=" 0.05mol/(" L?min)×5min=0.25mol/L。正确。C. 由于B物质的状态为固态,所以其浓度不会发生变化,因此不能用物质间的速率
本题难度:一般
2、简答题 在一体积为1L的容器中,通入一定量的N2O4,在100℃时发生如下反应,N2O4?

2NO2-Q(Q>0),其N2O4?和NO2?浓度变化如图如示.
(1)上述反应的平衡常数表达式为______,升高温度K值______(填“增大”、“减小”或“不变”)]
(2)在0-60s这段时间内,四氧化二氮的平均反应速率为______mol/L.s
(3)120℃时,在相同的容器中发生上述反应,容器内各物质的物质的量变化如图
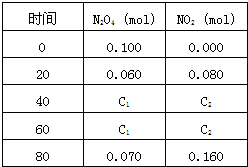
①该温度时,反应处于平衡状态的时间是______,C1的数值______0.04(填“大于”、“小于”或“等于”).
②反应在60-80s间平衡向逆反应方向移动,可能的原因是______
(A)?使用催化剂????(B)?减少N2O4的浓度
(3)减小体系压强???(D)?增加NO2的浓度.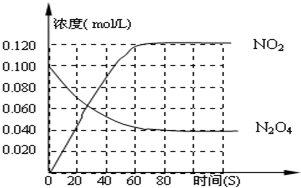
参考答案:(1))化学平衡常数指生成物浓度的化学计量数次幂的乘积除以各
本题解析:
本题难度:一般
3、选择题 下列叙述中,正确的是( )
A.在船舶的外壳装上铜块可防止其发生电化学腐蚀
B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率
C.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg
参考答案:A、铜和铁的活泼性不同,铜、铁和海水能构成原电池而加快铁的电
本题解析:
本题难度:一般
4、填空题 某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min)
| 1
| 2
| 3
| 4
| 5
|
氢气体积(mL)
| 50
| 120
| 232
| 290
| 310
(1)在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是 ,
原因为 ;反应速率最小的时间段是 ,
原因为 。(2)在2~3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:A .蒸馏水 B .Na2SO4溶液 C. NaNO3溶液 D. CuSO4溶液 E. Na2CO3 溶液, 你认为可行的是 。
参考答案:(11分)(1)2~3 min(1分),因该反应是放热反应,
本题解析:
试题分析:(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、120ml-50ml=70mL、232ml-120ml=112mL、290ml-232ml=68mL、310ml-290ml=20mL,由此可知反应速率最大的时间段为2~3 min。这是由于该反应为放热反应,温度升高,温度对反应速率的影响超过浓度对反应速率的影响,所以反应速率增大。反应速率最小的时间段是4~5min时间段,此时温度虽然较高,但H+浓度小,即浓度对反应速率的影响超过温度对反应速率的影响,因此反应速率降低。
(2)在2~3min时间段内,n(H2)=0.112L÷22.4L/mol==0.005mol,根据2HCl~H2可知,消耗盐酸的物质的量为0.01mol,其浓度为0.01mol÷0.1L=0.1mol/L,则υ(HCl)=0.1mol/L÷1min=0.1 mol/(L?min)。
(3)A、加入蒸馏水,H+浓度减小,反应速率减小,且不减少产生氢气的量,故A正确;B、加入Na2SO4溶液,相当于稀释,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;C、加入NaNO3溶液,在酸性条件下NO3-具有强氧化性,与金属反应得不到氢气,而是生成NO气体,影响生成氢气的量,故C错误;D、加入CuSO4溶液,Zn置换出Cu反应速度增大。但由于消耗锌,从而影响生成氢气的量,故D错误;E、加入Na2CO3溶液,消耗H+,H+浓度减小,影响生成氢气的量,故E错误,所以答案选AB。
考点:考查外界条件对反应速率的影响、影响反应速率条件的实验探究以及反应速率的计算
本题难度:一般
5、简答题 (14分)2SO2(g)+O2(g) 2SO3(g)是生产硫酸的主要反应之一。下表是原料气按 2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
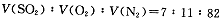 投料,在 投料,在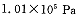 时,不同温度下SO2的平衡转化率。 时,不同温度下SO2的平衡转化率。

(1)该反应是_?????????反应(填“放热”或“吸热”)。
(2)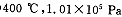 时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是????????mol。 时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是????????mol。
(3)硫酸厂尾气(主要成分为SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若尾气中SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,则有关该溶液的下列关系正确的是?????(填序号)。

②用MnO2与水的悬浊液吸收上述尾气并生产MnSO4
i.得到MnSO4的化学方程式是???????
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2的吸收率与溶液pH的关系如图乙。

图甲中pH变化是因为吸收中有部分SO2转化为H2SO4生成H2SO4反应的化学方程式是____;由图乙可知pH的降低???????SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是??????????????。
参考答案:(14分)
(1)放热
(2)0.08
(
本题解析:
试题分析:(1)温度升高二氧化硫的转化率降低,说明升高温度平衡逆向移动,所以正向为放热反应;
(2)该条件下二氧化硫的转化率为99.2%,所以10 mol SO2的原料气平衡时剩余10×(1-99.2%)="0.08mol" SO2
(3)①根据物料守恒规律,c(NH4+)+c(NH3·H2O)=2c(H2SO3)+2c(SO32-)+ 2c(HSO3-),a正确;b不符合电荷守恒规律,错误;(NH4)2SO3溶液为碱性溶液,说明SO32-的水解程度大于NH4+的水解程度,所以溶液中离
本题难度:一般
|