微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:
3P(g)+Q(g) xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是(????)
xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是(????)
A.5min内P的平均反应速率为0.15mol/(L·min)
B.Q的转化率为25%
C.Q的平衡浓度为1mol/L
D.x是2
参考答案:B
本题解析:根据M的反应速率可知,生成M是0.1mol/(L·min)×2L×5min=1mol,根据变化量之比是相应的化学计量数之比可知,x=2。生成1molN的同时,消耗0.5molB,所以B的转化率是20%,B不正确。B的平衡浓度是2mol÷2L=1mol/L,C正确。反应速率之比是相应的化学计量数之比,因此A正确,答案选B。
本题难度:一般
2、选择题 已知某可逆反应aA(g) + bB(g)  ?cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的
?cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的
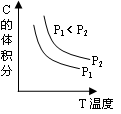
A.正反应为吸热反应
B.降低温度,正反应速率增大
C.a + b < c + d
D.增大压强,B转化率增大
参考答案:D
本题解析:根据图像可知,随着温度的升高,C的体积分数降低。说明升高温度平衡向逆反应方向移动,因此正反应是放热反应,A不正确;降低温度,反应速率一定是减小的,B不正确;当温度相同时,压强越大,C的体积分数越大。说明增大压强,平衡向正反应方向移动,即正反应是体积减小的,所以C不正确,D正确,答案选D。
本题难度:简单
3、填空题 (16分)已知2A(g)+B(g)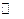 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
⑴比较a?? ▲??b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1?? ▲??T2(填“>”? “=”或“<”)。
T/K
| T1
| T2
| T3
|
K
| 1.00×107
| 2.45×105
| 1.88×103
????若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度?? ▲??(填“>”“=”或“<”)ωmol/L,a、b、c之间满足何种关系?? ▲??(用代数式表示)。
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是?? ▲??。
A. 4molA和2molB???????????????????????????? B. 4molA、2molB和2molC
C. 4molA和4molB????????????????????????????? D. 6molA和4molB
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是?? ▲??。
A. 及时分离出C气体???????????????????????? B. 适当升高温度
C. 增大B的浓度??????????????????????????????? D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d?? ▲??b(填“>”“=”或“<”),理由是????? ▲??????。
⑹ 在一定温度下,向一个容积可变的容器中,通入3molA和2molB及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量?? ▲??(填“不变”“变大”“变小”或“无法确定”)。
参考答案:(16分)
⑴ a>b(2分)????????????
本题解析:略
本题难度:一般
4、选择题 下列说法能表示可逆反应N2+3H2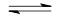 2NH3处于平衡状态的是 2NH3处于平衡状态的是
A.3mol氢气和1mol氮气恰好完全反应,得到2mol氨气
B.正反应生成NH3的速率和逆反应生成H2的速率相等
C.单位时间消耗n mol N2的同时消耗2n mol NH3
D.N2、H2、NH3的质量分数相等
参考答案:C
本题解析:
试题分析:该反应是可逆反应,不能彻底反应,故不可能得到2mol氨气,故A错误;正反应生成NH3的速率和逆反应生成H2的速率之比为2:3,才达到平衡状态,B错;平衡状态时,各物质的质量分数保持不变,但是不一定相等,D错。
点评:判断一个反应是否达到平衡状态,是历年高考的重点。考生在备考过程中应抓住实质、通过标志进行分析。难度中等,一般以选择题出现。
本题难度:一般
5、选择题 在一定条件下,对于反应mA(g)+nB(g)  cC(g)+dD(g),C物质的体积分数(C%)与温度、压强的关系如图所示. cC(g)+dD(g),C物质的体积分数(C%)与温度、压强的关系如图所示.

下列判断正确的是
A.ΔH<0 m+n>c+d
B.ΔH<0 m+n<c+d
C.ΔH>0 m+n>c+d
D.ΔH>0 m+n<c+d
参考答案:B
本题解析:由图分析可知,在相同温度下,压强越大C%越小,即增大压强,平衡向逆反应方向移动,即逆反应方向为气体体积减少的方向,得m+n<c+d;在相同压强下,随温度的升高C%减少,即升高温度C%减少即正反应方向为放热反应,ΔH<0;所以正确选项为B;
本题难度:一般
|