微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g)  CO(g)+3H2(g);△H1=+216kJ/mol;CH4(g)+ CO2(g)
CO(g)+3H2(g);△H1=+216kJ/mol;CH4(g)+ CO2(g) 2CO(g) + 2H2(g); △H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
2CO(g) + 2H2(g); △H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是

A.增大催化反应室的压强,甲烷的转化率减小
B.催化室需维持在550~750℃,目的仅是提高CH4转化的速率
C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应
D.若催化反应室中,达到平衡时,容器中n(CH4)=amol,n(CO)=bmol
n(H2)=cmol,则通入催化反应室的CH4的物质的量为a+(b+c)/4
参考答案:
AD
本题解析:
本题考查化学平衡。从题意可知,催化反应室发生两个可逆反应,增大压强,平衡逆向移动,甲烷的转化率减小,A选项正确;温度的要求还要考虑催化剂的活性,B选项错误;设置燃烧室的目的除了提供原料气之外,还提供了能量,C选项错误;
CH4(g)+H2O(g)  CO(g)+3H2(g)???? CH4(g)+ CO2(g)
CO(g)+3H2(g)???? CH4(g)+ CO2(g) 2CO(g) + 2H2(g)
2CO(g) + 2H2(g)
起始:? m???????????????? 0??? 0???????? n?????????????????? 0???? 0????????????????????????????????????????????????????????????????????????????
转化:? x???? x?????????? x??? 3x???????? y????? y?????????? 2y??? 2y??????????????????????????????????????????????
平衡:? m-x?????????????? x??? 3x???????? n-y???????????????? 2y??? 2y?
有x+2y=b,3x+2y="c??" 得出x+y=(b+c)/4,而平衡时n(CH4)=m-x+n-y=amol,则通入催化反应室的CH4的物质的量为m+n=a+x+y=a+(b+c)/4mol,D选项正确。
本题难度:一般
2、选择题 在容积为2L的密闭容器中,有反应: mA(g)+nB(g) pC(g)+qD(g),经过5分钟达到平衡,此时各物质的变化为:A减少amol/L,C增加2a/3mol/L,B的平均反应速率VB=a/15mol/(L·min),这时若增加体系压强,发现A与C的百分含量不变,则m:n:p:q为 [???? ]
pC(g)+qD(g),经过5分钟达到平衡,此时各物质的变化为:A减少amol/L,C增加2a/3mol/L,B的平均反应速率VB=a/15mol/(L·min),这时若增加体系压强,发现A与C的百分含量不变,则m:n:p:q为 [???? ]
A.3:1:2:2
B.1:3:2:2
C.1:3:2:1
D.1:1:1:1
参考答案:A
本题解析:
本题难度:一般
3、填空题 (8分)某工厂实验室用CO和H2制备CH3OH,其原理为:
CO(g)+2H2(g)  ?CH3OH(g)?△H < 0
?CH3OH(g)?△H < 0
试回答下列问题:
(1)若该反应在298K、398K时,化学平衡常数分别为K1、K2,则K1 K2(填“>”、“<”、“=”)
(2)在恒温恒容条件下,判断该反应达到化学平衡状态的是
A.v正(H2)=2 v正(CH3OH)
B.v正(H2)=v正(CO)
C.容器内压强保持不变
D.混合气体的密度不变
(3)某温度下,向一定容积的密闭容器中充入CO和H2,浓度分别为1mol/L和2mol/L,达到平衡时CO的 浓度为0.6mol/L,试求该温度下的化学平衡常数。
浓度为0.6mol/L,试求该温度下的化学平衡常数。
参考答案:(1)>??(2)C???(3)0.46 L2/mol2
本题解析:略
本题难度:一般
4、选择题 将0.6molA和0.5molB充入0.4L密闭容器中发生2A(g)+B(g)?mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2mol.又知5min内用E表示的平均反应速率为0.1mol?L-1?min-1,下列结论正确的是( )
A.A、B的转化率均为20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1mol?L-1?min-1
D.平衡时混合物总物质的量为1mol
参考答案:v(D)=0.2m
本题解析:
本题难度:一般
5、填空题 (共12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O(g)的浓度随时间变化如下图所示:
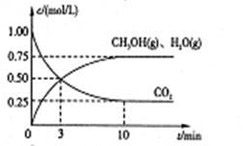
(1)从反应开始到平衡,氢气的平均反应速率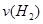 =??????????mol/(L·min)
=??????????mol/(L·min)
(2)该条件下CO2的转化率为????????????。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是???????????????????。
A.升高温度
B.恒容时充入氮气
C.将水蒸气从体系中分离
D.用更有效的催化剂
Ⅱ.下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:

(1)M极的电极材料为 ????????????。
(2)加入乙醇的铂电极的电极反应式为?????????????????????????????????。
(3)在此过程中乙池中某一电极析出金属银4.32g时,此时乙池溶液的体积为400mL,则乙池中溶液的pH为???????????。
(4)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为??????????????????????。
参考答案:(14分)
Ⅰ:(1) 0.225??(2) 75%?
本题解析:
试题分析:Ⅰ.(1)①v(CO2)= 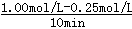 =0.075mol/(L?min),则v(H2)=3×v(CO2)=0.225mol/(L?min),故答案为:0.225;
=0.075mol/(L?min),则v(H2)=3×v(CO2)=0.225mol/(L?min),故答案为:0.225;
(2)由(1)得知,CO2反应了0.75mol,所以CO2的转化率等于0.75mol*100%/1mol=75%;
(3)使n(CH3OH)/n(CO2)增大应使平衡向正反应方向移动:
A.该反应正反应为放热反应,则升高温度平衡向逆反应方向移动,故A错误;
B.充入He气,参加反应的物质的浓度不变,平衡不移动,故B错误;
C.将H2O(g)从体系中分离,生成物浓度减小,平衡向正反应方向移动,故C正确;
D.使用催化剂只能加快反应速率,不能使化学平衡移动,故D错误。
故答案为:C。
Ⅱ.(1)作时M、N两个电极的质量都不减少,M为阴极得到电子,N为阳极是失电子的,综合分析,M极的电极材料为铁。
(2)加入乙醇的电极是负极,失去电子,电极反应式为C2H5OH-12e+16OH—=2CO32—+11H2O。
(3)发生的反应为:
阴极反应:4Ag+ 4e- ==4Ag
阳极反应:4OH- +4e- ==2H2O+O2↑
总反应:4AgNO3 + 2H2O ==4HNO3 + 4Ag+ O2↑
N(Ag)=4.32g/108(g/mol)=0.04mol,n(HNO3)=0.04mol,即n(H+)=0.04mol,c(H+)=0.04mol/0.4L=0.1mol/L,PH=1。
点评:本题考查较为综合,涉及反应速率、平衡常数、平衡移动以及电化学等知识,题目难度不大,注意把握影响平衡移动的因素以及平衡移动方向的判断。
本题难度:一般