0.20
?
(1)该反应的平衡常数表达式为????????????????????????????????。
(2)平衡时,甲容器中CO的转化率是???????。比较下列容器中CO的转化率:乙???????甲;丙???????甲(填“>”、“=”或“<”)。
(3)丙容器中,若要通过改变温度,使CO的平衡转化率增大,则温度需要降低才能达到,则降温后的平衡常数K?????(填“增大”、“减小”或“不变”)。
参考答案:(1)K= 本题解析: 本题解析:
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据CO(g)+H2O(g) CO2(g)+H2(g)可知,该反应的平衡常数表达式为:K═ CO2(g)+H2(g)可知,该反应的平衡常数表达式为:K═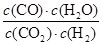 。 。
(2)设甲容器中CO消耗的物质的量为x
CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g)
初始量(mol)0.1???? 0.1??????0?????? 0
变化量(mol)x??????x??????? x?????? x
平衡量(mol)0.1-x?? 0.1-x???? x?????? x
则K= =1 =1
解得x=0.5,所以甲容器中CO的转化率=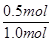 ×100%=50%; ×100%=50%;
根据投料情况知道,乙相当于在甲的基础上增加了水蒸气的投料,所以会使得一氧化碳的转化率增大,丙装置投料是甲装置的2倍,对于化学反应前后系数和不变的反应来说,建立的平衡是等效的,所以两种情况下,转化率是相等的。
③丙容器中,通过改变温度,使CO的平衡转化率增大,需要使化学平衡向着正向移动,由于该反应为放热反应,要增大一氧化碳的转化率,应该降低温度;由于平衡向着正向移动,反应物浓度减小,生成物浓度增大,则该反应的化学平衡常数增大。
本题难度:简单
2、选择题 在一定温度下,恒容密闭容器中,充入一定量的NO和O2,发生2NO+ O2 2NO2,反应达到平衡的标志是 2NO2,反应达到平衡的标志是
① NO、O2、NO2分子数目比是2:1:2???②反应混合物中各组分物质的浓度相等
③混合气体的颜色不再改变?????????????④混合气体的密度不再改变
⑤混合气体的平均相对分子质量不再变化??⑥?υc(O2)(正) = υ c(NO2)(逆)=1:2
A.②
B.①②
C.②③④
D.③⑤⑥
参考答案:D
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。颜色深浅和浓度有关系,所以③正确;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,①②不正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,④不正确;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,⑤可以说明;⑥中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确,答案选D。
本题难度:一般
3、选择题 反应N2O4(g)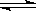 2NO2(g)⊿H = +57KJ/mol,在温度为 2NO2(g)⊿H = +57KJ/mol,在温度为 、 、 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 (??????????) 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 (??????????)
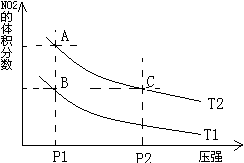
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
参考答案:C
本题解析:A、C两点:在相同温度下,P2>P1,则应υ(C) >υ(A),故A错误;
由于C点压强大,那么容器体积是减小的,所以气体被压缩,则看起来C点颜色深了,尽管C中NO2的体积分数比A小,但是平衡移动是微弱的,比不过体积改变对颜色的影响,故B错误;
C项,加热,平衡右移,正确;
平均相对分子质量=气体总质量/气体总物质的量,气体总质量不变,而由A点到C点,压强增大,平衡左移,所以气体总物质的量减小,则气体的平均相对分子质量增大,即:C>A,故D错误;
本题难度:一般
4、选择题 X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:
X+2Y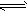 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率为[???? ] 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率为[???? ]
A.33%
B.40%
C.50%
D.66.7%
参考答案:D
本题解析:
本题难度:一般
5、选择题 (14分)乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:
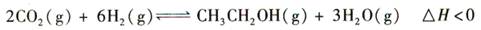
请回答:
(1)该反应的化学平衡常数表达式为?????????????????????????????????。
(2)当温度T1>T2时,化学平衡常数K1???????????K2(填“>”、“<”或“=”)。
(3)在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是???????(填字母序号)。
a.生成1molCH3CH2OH的同时生成3 mol H2O
b.容器中各组分浓度不随时间而变化
c.容器中混合气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有??????????????????????????(写出一条合理措施即可)。
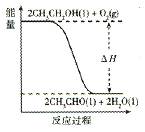
(5)工业上,常以乙醇为原料生产乙醛。根据下图所示信息,该反应是??????????????反应(填“放热”或“吸热”),判断依据是__________________。
(6)乙醇可以作为燃料电池的燃料。某乙醇燃料电池以乙醇为燃料,使用酸性电解质,该电池负极反应的电极反应式为????????????????????????????????。
参考答案:(1) 本题解析: 本题解析:
试题分析:(1)根据化学平衡常数表达式的书写原则,该反应的化学平衡常数表达式见答案;(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数减小,即温度越高,平衡常数越小,温度T1>T2,K1<K2;(3)a.利用正逆反应速率相等作为平衡标志,注意“双向同时,符合比例”,生成1mol?CH3CH2OH的同时,生成3mol?H2O,都表示正反应速率,不能说明到达平衡,错误;b.可逆反应到达平衡时,各组分的物质的量不变,体系中各组份的物质的量浓度不随时间而变化,说明到达平衡,正确;c.反应混合气体的总质量不变,容器的体积不变,密度始终不变,体系中混合气体的密度不随时间而变化,不能说明到达平衡,错误;d.随反应进行混合气体总的物质的量减小,体系中气体的分子总数减少,体系中气体分子总数不随时间而变化,说明到达平衡,正确;选bd;(4)改变条件加快反应速率,同时平衡向正反应移动,可以增大CO2浓度或增大压强,反应速率加快,平衡向正反应移动氢气的转化率增大;(5)由图象可知,反应物的总能量大于生成物的总能量,故该反应物为放热反应;(6)燃料电池负极反应氧化反应,乙醇在负极放电,酸性条件下生成二氧化碳与氢离子,电极反应式为:CH3CH2OH-12?e-+3H2O=2CO2+12H+。
本题难度:一般
|