微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2? ?2Cu + SO2
?2Cu + SO2
方法二:湿法炼铜:CuSO4?+ Fe FeSO4?+ Cu
FeSO4?+ Cu
上述两种方法中,你认为哪种方法更好????????,原因是?????????(写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为?????????????????。
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下:
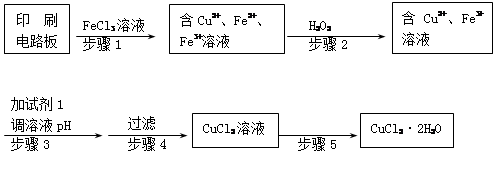
①步骤2中反应的离子方程式是????????????????????。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为?????????????????????????????????????
④步骤3中可选用的“试剂1”是??????(写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为????????????????????[Ksp(Fe(OH)3)=4×10-38]。
参考答案:Ⅰ湿法炼铜(或方法二)不会产生污染空气的气体(或湿法炼铜不需
本题解析:
试题分析:Ⅰ第一种方法会产生大气污染物SO2,而且要消耗大量的能量,而第二种方法在常温下就可以发生,产物都是无污染的。因此第二种方法好。由反应方程式可以看出产生2mol的Cu电子转移6mol,因此产生640gCu即10mol的Cu,电子转移30mol;而在湿法炼铜中产生1mol的Cu电子转移2mol,因此产生640gCu即10mol的Cu,电子转移20mol,所以转移电子的物质的量的比为3:2。Ⅱ①根据图示可知在步骤2中反应的离子方程式是2Fe2++ H2O2 +2H+ = 2Fe3+ + 2H2
本题难度:一般
2、填空题 (9分)按要求写出下列反应的化学方程式或离子方程式
(1)钢铁工业是国家工业的基础。请回答:
①写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:???????????????????
②在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。
写出铁粉和水蒸气反应的化学方程式:?????????????????????????????????????
(2)铝片放入NaOH溶液中有气体生成,写出反应的离子方程式:??????????????????????
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
3、实验题 某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下:提出猜想
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
I.解决问题1
(1)需用到的药品除1 mol·L-1CuSO4溶液、稀硫酸外还需________(填试剂的化学式)溶液。
(2)用胆矾晶体配制1 mol·L-1CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管外,还有______________(填仪器名称)。
(3)为达到实验目的,请你补全实验内容和步骤:
①用CuSO4溶液制备Cu(OH)2;
②__________________________________________________________________________。
Ⅱ.解决问题2
取一定量I中制备获得的氢氧化铜固体于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题。
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:_______________________。
(2)从实验Ⅱ可得出的结论是在高温下正一价铜比正二价铜________(填稳定或不稳定),溶液中正一价铜比正二价铜_________(填稳定或不稳定)。
Ⅲ.解决问题3
设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的单质气体Y;将X通人灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36g,并收集到0.28g气体Y。
(1)仪器A的名称是_____________________。
(2)X的化学式为_______________________。
参考答案:I (1)NaOH????(2)250mL容量瓶
(3
本题解析:
试题分析:Ⅰ(1)、探究氢氧化铜是否具有两性的实验需要的药品是:制取氢氧化铜的硫酸铜和氢氧化钠,验证试验用到硫酸和氢氧化钠,所以需要硫酸铜和氢氧化钠以及硫酸溶液,即需用到的药品除1 mol·L-1CuSO4溶液、稀硫酸外还需氢氧化钠溶液;(2)配制一定物质的量浓度的溶液所需仪器:烧杯、天平、玻璃棒、量筒、胶头滴管、一定体积的容量瓶,容量瓶的规格根据所配置的溶液来确定,故答案为:250mL容量瓶;(3)氢氧化铜是否能和硫酸和氢氧化钠反应的实验中,首先是氢氧化铜的配制,然后是让氢氧化铜和硫酸以及氢氧化
本题难度:一般
4、选择题 将下列各种单质投入或通入CuSO4溶液中,能产生铜单质的是
A.Fe
B.Na
C.H2
D.Ag
参考答案:A
本题解析:
根据金属活动性顺序表,铜之前的金属铁可以从铜的盐溶液中置换出铜,铜之后的银不可。只有金属能置换铜,氢气不能置换铜。钠虽然在铜之前,但是钠太活泼了,投入溶液中会与溶液中的水反应,置换出氢气,不能置换出铜。
本题难度:简单
5、填空题 (6分)金属是人类生产、生活中不可缺少的重要材料
(1)生铁是???(填化学式)和铁的合金,生铁的硬度比纯铁???(填高、低)。
(2)生铁放置在潮湿的空气发生电化学腐蚀时的正极反应为?????????????????????????;负极反应为?????????????????????????;用盐酸可以除去生铁表面的铁锈,该反应的离子方程式为????????????????????????????。
(3)下列对金属制品采取的防护方法不正确的是??????(填序号)。
①在电线的外面包上一层塑料层
②在自行车钢圈上镀上一层金属铬
③在海轮的铁制外壳上焊上铜块
④在铁制的暖气片上刷一层油漆
参考答案:(1)C?高???(2) O2+2H2O+4e-=4OH-?
本题解析:
试题分析:(1)生铁是一种合金,主要含有碳元素。合金的硬度一般大于个成分金属的硬度,即生铁的硬度比纯铁高。
(2)生铁主要是发生吸氧腐蚀,其中铁是负极,失去电子,氧气再正极得到电子。电极反应式分别是正极:O2+2H2O+4e-=4OH-、负极:2Fe-4e-=2Fe2+。铁锈的主要成分是氧化铁,和盐酸反应的方程式是Fe2O3+6H+=2Fe3++3H2O。
(3)由于铜的金属性弱于铁的,所以如果在海轮的铁制外壳上焊上铜块,则发生电化学腐蚀时,铁是负极,加速腐蚀,③不正确,其 余选项都是正
本题难度:一般