微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在工业生产中,H2SO4的下列用途不正确的是( )?
A.制取漂白粉
B.制取肥田粉?
C.制取氢氟酸
D.制造农药和炸药?
参考答案:A
本题解析:漂白粉是将Cl2通入石灰乳中制得的,与H2SO4无关。肥田粉是指农用(NH4)2SO4,其合成原理是:
2NH3+H2SO4====(NH4)2SO4
浓H2SO4是制取肥田粉不可缺少的原料。氢氟酸是HF(g)溶于水制得的,HF(g)是用浓H2SO4与天然CaF2(萤石)反应制得的:
CaF2+H2SO4 本题难度:简单
本题难度:简单
2、实验题 [2012·东北哈师大附中、东北师大附中、辽宁省 实验中学第二次联合模拟](16分)某同学为了探究铜与浓硫酸的反应,进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
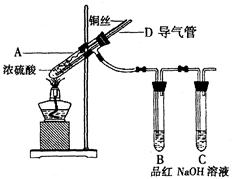
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将铜丝向上提至离开液面。
(1)装置A中发生反应的化学方程式为??????????????????。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是???????????。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操是?????????????????????????????。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下图的实验:
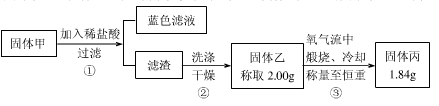
(4)②中检验滤渣是否洗涤干净的实验方法是??????????????????????????????。
(5)③中在煅烧过程中一定发生的反应的化学方程式为??????????????????????。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项)??????????????。
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中可能有Cu2S
参考答案:(16分)(1)2H2SO4(浓)+Cu 本题解析:(6)由滤液呈蓝色可知,固体甲中含CuO和Cu2O至少有一种。煅烧CuS的反应方程式为2CuS+3O2
本题解析:(6)由滤液呈蓝色可知,固体甲中含CuO和Cu2O至少有一种。煅烧CuS的反应方程式为2CuS+3O2 2CuO+2SO2,由该方程式可计算出2gCuS煅烧后固体质量减少0.33g;煅烧Cu2S的反应方程式为Cu2S+2O2
2CuO+2SO2,由该方程式可计算出2gCuS煅烧后固体质量减少0.33g;煅烧Cu2S的反应方程式为Cu2S+2O2 本题难度:一般
本题难度:一般
3、选择题 下列有关H2SO4的说法中正确的是
A.将过量的Zn投入一定量的浓H2SO4中,最终生成的气体只有SO2
B.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体
C.运输保存浓硫酸的槽罐车一旦泄露后应立即用大量水冲洗
D.向5 mL 18 mol·L-1的硫酸中加入足量铜片并加热使其充分反应,生成0.045 mol SO2
参考答案:B
本题解析:
试题分析:A、将过量的Zn投入一定量的浓H2SO4中,一开始二者反应生成硫酸锌、二氧化硫和水,随着反应的进行,硫酸的浓度逐渐变稀,锌与稀硫酸反应,生成硫酸锌和氢气,错误;B、向装有Fe(NO3)2溶液的试管中加入稀H2SO4,H+、NO3—与Fe2+发生氧化还原反应生成一氧化氮,在管口被氧化为红棕色的二氧化氮,正确;C、运输保存浓硫酸的槽罐车一旦泄露后,用大量水冲洗,浓硫酸被稀释,稀硫酸与槽罐反应产生可燃性气体氢气,错误;D、向5 mL 18 mol·L-1的硫酸中加入足量铜片并加热使其充分反应,
本题难度:一般
4、选择题 下图是探究铜丝与过量浓硫酸反应的实验,下列叙述不正确的是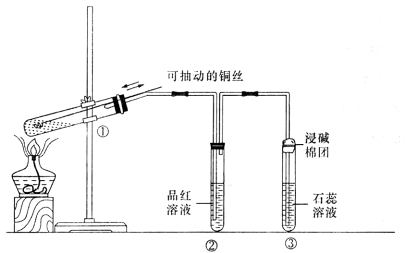
A??浸碱棉团的作用是吸收SO2
B. ②中品红溶液的作用检验SO2的生成
C. ③中石蕊溶液褪色
D.  若把①试管中的生成物倒人水中发现溶液变蓝
若把①试管中的生成物倒人水中发现溶液变蓝
参考答案:C
本题解析:略
本题难度:一般
5、实验题 有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:①铜与浓硫酸加热直接反应,即Cu→CuS04
②将铜加到热的稀硫酸中并通入空气来制备硫酸铜,即由Cu→CuO→CuSO4,
试回答:
(1)、写出方案①的化学反应方程式???????????????????????????????????????
这两种方案,你认为哪一种方案比较合理????????。(答编号),理由是
??????????????????????????????????????????????????????????????????????
(2)、实验室采用方案①取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲、乙两位同学为了验证其中灰白色沉淀的主要成分,设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌
实验现象:_____________________________________________
实验结论:所得灰白色固体的化学式为_???_______
直到最后反应完毕,发现试管中还有铜片剩余。可两位同学仍然认为试管中还有硫酸剩余,他们这样认为的理由是___________?????????????????????_____
参考答案:(1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
本题解析:
试题分析:(1)方案②合理,原因是不产生污染物二氧化硫、生成同质量硫酸铜消耗硫酸少。
(2)铜与浓硫酸反应时,硫酸过量,生成硫酸铜、二氧化硫和水。随着反应进行,硫酸由浓变稀,铜与稀硫酸不反应。向灰白色固体中加水,固体溶解,若溶液呈蓝色,说明灰白色固体是硫酸铜。
点评:评价实验方案优劣可从以下几个方面进行:1.对环境是否友好;2.原料来源是否广泛、原料是否经济;3.生成等质量的产品所需原料越少越好。
本题难度:一般