微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)为测定某卤代烃分子中所含有的卤原子的数目和种类,可按下列步骤进行实验:①量取该卤代烃液体11.4 mL;②加入适量氢氧化钠溶液,煮沸至液体不分层;③冷却后加入稀硝酸酸化;④加入硝酸银溶液至沉淀完全;⑤过滤,洗涤沉淀并干燥;⑥称取干燥后的沉淀 的质量。
的质量。
回答下列问题:
(1)加入氢氧化钠溶液的目的是___________________________________________
(2)加入过量硝酸银溶液的目的是__________________________________________
(3)若加入硝酸银溶液时产生的沉淀为浅黄色,则此卤代烃中的卤原子是_____________(4)若所称干燥的沉淀的质量为37.6g,又知其卤代烃液体的密度是1.65g/cm3,其蒸气密度是相同状况下甲烷密度的11.75倍。则该卤代烃的每一个分子中含卤原子的数目为______,该卤代烃可能的结构为_____________________________________________
参考答案:(1)使卤代烃水解,产生自由的卤离子,以便检验和计算卤离子的
本题解析:略
本题难度:简单
2、填空题 利用如图所示的装置和其他必要的仪器用品,完成下列实验。

(1)证明氨气具有还原性。已知2NH3+3CuO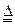 N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是???????????????,稀硫酸的作用是?????????????????。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?????????????????????????????????
???????????????????????????????????????????????。
③证明NH3具有还原性的实验现象是???????????????????????????????????????。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O==(NH4)2 Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe外将转化为沉淀。
①吸收了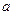 ?mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。?????????????????????????????????
?mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。?????????????????????????????????
??????????????????????????????????????????????????。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是????????????????。
参考答案:①吸收水蒸气?吸收氨气?②NaOH吸收溶液中水分放热,使溶液
本题解析:①吸收水蒸气?吸收氨气?②NaOH吸收溶液中水分放热,使溶液温度升高,氢氧根离子浓度增大,都有利于氨气的逸出?③黑色粉末变为红色,有无色液滴产生? (2)①加入稀H2SO4调节溶液至酸性(答“调pH=8.1以下”给分).加入约0.5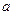 mol硫酸亚铁的浓溶液,搅拌.?②加热浓缩;冷却结晶;过滤。
mol硫酸亚铁的浓溶液,搅拌.?②加热浓缩;冷却结晶;过滤。
本题难度:一般
3、选择题 1.下列实验操作中,正确的是???????????????????????????????????( ??)
A.把pH试纸浸入待测溶液中,测定溶液的pH
B.称NaOH固定质量时。将NaOH固体放在垫有滤纸的托盘上进行称量
C.苯酚沾在皮肤上,应立即用酒精清洗
D.浓硫酸溅在皮肤上,应立即用烧碱溶液冲洗
参考答案:C
本题解析:略
本题难度:简单
4、实验题 (12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为?????????????????????;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:??????????????????????????????
?????????????????????????????????????????????????????????????。
⑵过程I加入铁屑的主要作用是_______????????;从固体中分离出铜需采用的方法是_________?????????????????????????????????。
⑶过程II中发生主要反应的化学方程式为:_____?????????,?????????????。
参考答案:⑴2Fe3++Cu=2Fe2++Cu2+?取少量反应后的溶液
本题解析:
试题分析:(1)对离子方程式的书写,应注意配平。该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+。检验铁离子的存在应用KSCN溶液。注意语言的描述“取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明仍存在Fe3+”
(2)加入铁屑的主要目的是除去铜离子,回收铜单质。因铜不溶于酸溶液,因此可滴加稀盐酸,使多余的铁反应,从而得到铜单质。
(3)过程Ⅱ加入了石灰水,同时还鼓入了空气,因此发生的反应为FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3。
点评:本题主要考查了金属的相关性质及其化学方程式的书写。书写化学方程式时,应注意化学方程式的配平。
本题难度:一般
5、实验题 (17分)若用12 mol?L-1的浓盐酸配制0.10 mol?L-1的稀盐酸500 mL,回答下列问题:
(1)量取浓盐酸的体积为??????mL,如果实验室有5mL、10mL、50mL量筒,应选用???mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将??????(偏高、偏低、无影响)。
(2)配制时应选用的容量瓶规格为?????mL ,除容量瓶还需选用的仪器主要有?????????、?????????、???????和????????。
(3)配制时,将量取的浓盐酸沿烧杯内壁慢慢注入约100mL水里,并不断搅拌,目的是?????????????????????????????????????????????????????。
(4)将冷却后的上述溶液沿???????????注入???????????中,并用约50mL蒸馏水洗涤烧杯2~3次,转移摇匀。(填仪器)
(5)加水至距刻度线?????????????????? 处,改用?????????????(填仪器)滴加水,使溶液的凹液面正好跟刻度线相切,最后盖上瓶塞,摇匀。
处,改用?????????????(填仪器)滴加水,使溶液的凹液面正好跟刻度线相切,最后盖上瓶塞,摇匀。
(6)若实验遇下列情况,溶液的浓度是偏高 ,偏低还是不变?
,偏低还是不变?
A.加水时越过刻度线______
B.忘记将洗涤液加入容量瓶______
C.容量瓶内壁附有水珠而未干燥处理
D.溶解后没有冷却便进行定容
参考答案:
 本题解析:略
本题解析:略
本题难度:一般