微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质分离方法不正确的是[???? ]
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用分液的方法分离汽油和氯化钠溶液
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列实验方法不正确的是( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用四氯化碳萃取碘水中的碘
D.除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
参考答案:A.泥沙不溶于水,NaCl溶于水,可用过滤的方法分离,故A正
本题解析:
本题难度:简单
3、填空题 碳酸锂广泛应用于陶瓷和医药等领域,以β—锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:
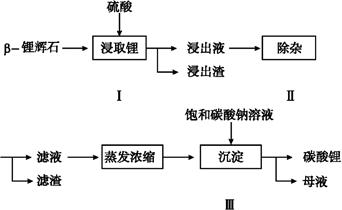
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g。
(1)步骤Ⅰ前,β—锂辉石要粉碎成细颗粒的目的是 。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-;另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有 。
(4)步骤Ⅲ中,生成沉淀的离子方程式为 ??????????????????????????????????????。
(5)从母液中可回收的主要物质是 ??????????????????????????????????。
参考答案:(1)增大反应物间的接触面积,加快反应速率
(2)石灰
本题解析:
试题分析:(1)将固体物质粉碎,可增大反应物的接触面积,从而加快反应速率。
(2)加入石灰石能与溶液中的H+反应,使pH升高;加入CaCl2不能发生反应,故不能调节pH;加入稀H2SO4,增大了H+浓度,pH减小,此步骤中因pH为6.0~6.5可将Fe3+、Al3+除去。
(3)加入H2O2溶液,可将Fe2+氧化为Fe3+,加入石灰乳与Na2CO3溶液,可使Fe3+、Mg2+、Ca2+分别转化为沉淀而除去。
(4)由于Li2CO3溶解度相对较小,所以步骤Ⅲ中生成沉淀的离子方程式为CO32—+2Li+=Li2CO3↓。
(5)据(4)中步骤Ⅲ的反应实质可知,母液中可回收的主要物质为Na2SO4。
本题难度:困难
4、选择题 同温同压下,某空瓶充满N2时重114 g,充满CO2时重122 g,充满某气体时重116 g,则某气体的相对分子质量是
A.44
B.28
C.60
D.32
参考答案:D
本题解析:
本题难度:简单
5、填空题 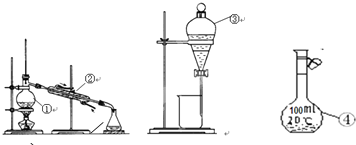
(1)写出图中仪器的名称③______;④______;
(2)仪器①~④中,使用时必须检查是否漏水的有______.(填仪器序号)
(3)分离碘水中的碘应先选择装置______(填装置序号)进行操作A.进行操作A时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:______(填序号).
①I2在其中溶解度比水中大②与水互不相溶③密度要比水大.
参考答案:(1)由仪器的图形可知③为分液漏斗,④为容量瓶,故答案为:分
本题解析:
本题难度:一般