微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA
B.22.4L SO2含有NA个SO2分子
C.1.6g CH4所含的电子数为NA
D.标况下,4.48L的水中含有H2O分子的数目为0.2NA
参考答案:C
本题解析:
试题分析:A.5.6 g Fe即0.1mol铁和足量的盐酸完全反应失去电子数为0.2NA,A错误;B.22.4L SO2的物质的量不一定是1mol,因为不能确定其所处的状态,则不一定含有NA个SO2分子,B错误;C.1.6g CH4的物质的量是0.1mol,所含的电子数为NA,C正确;D.标况下水不是气态,不能适用于气体摩尔体积,D错误,答案选C。
考点:考查阿伏伽德罗常数的计算
本题难度:一般
2、选择题 人体的血糖浓度(血液中葡萄糖的含量)是人体的重要生理指标,其值常以两种计量单位表示,即“m?mol/L”和“mg/d?L”(1L=10dL).以“mmol/L”表示时,人的血糖正常值在3.61~6.11m?mol/L之间,下列血糖浓度属于正常值的是
A.2.88m?mol/L
B.0.008m?mol/L
C.95mg/dL
D.52mg/dL
参考答案:C
本题解析:分析:以“mmol/L”表示时人的血糖正常值在3.61~6.11mmol/L之间,由1L=10dL,m=n×M来计算以“mg/dL”表示的血糖正常值范围,据此结合选项判断.
解答:以“mmol/L”表示时人的血糖正常值在3.61~6.11mmol/L之间,则以“mg/dL”表示的血糖正常值范围为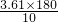 g/dL~
g/dL~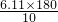 g/dL,即为64.98g/dL~109.98g/dL,
g/dL,即为64.98g/dL~109.98g/dL,
A.2.88m?mol/L不在人的血糖正常值在3.61~6.11mmol/L之间,故A错误;
B.0.008m?mol/L不在人的血糖正常值在3.61~6.11mmol/L之间,故B错误;
C.95mg/dL在人的血糖正常值在64.98g/dL~109.98g/dL之间,故C正确;
D.52mg/dL不在人的血糖正常值在64.98g/dL~109.98g/dL之间,故D错误;
故选C;
点评:本题以人体的血糖浓度为载体,考查物质的量浓度的有关计算,难度不大,理解以“mg/d?L”表示的浓度是解题关键.
本题难度:一般
3、选择题 NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4L任意比的氢气与氧气的混合气体中的分子总数均为2NA
B.标准状况下,22.4L水中含有NA个O—H键
C.足量铜与1L18mol·L-1浓硫酸反应可以生成SO2分子总数为9NA
D.100mL0.1mol·L-1HNO3溶液中含有0.01NA个NO3-
参考答案:D
本题解析:
试题分析:标准状况下,气体摩尔体积为22.4mol·L-1,气体物质的量为1mol,1mol任何气体在标准状况下分子数均是NA,和气体的种类无关,所以22.4L任意比的氢气与氧气的混合气体中的分子总数均为NA,A选项不正确,标况下,水是液态不是气体,故其物质的量远远大于1mol,B选项不正确,过量的铜与浓硫酸反应,随着反应进行浓度变稀,稀硫酸与铜不反应,可产生SO2气体分子小于9NA个,C选项不正确,0.1L×0.1mol·L-1=0.01mol,0.01molHNO3溶液中含有0.01NA个NO
本题难度:一般
4、选择题 NA代表阿伏加德罗常数的数值,下列说法正确的是
A.1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA
B.标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
C.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
D.1 mol Na被完全氧化生成Na2O2,失去2 NA个电子
参考答案:A
本题解析:
试题分析:A、1个(-14C1H3)中含有的质子数是6+3=9,中子数是14-6+0=8,所以1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA,正确;B、标准状况下氯仿不是气体,所以11.2L的氯仿的物质的量不是0.5mol,则含有的C-Cl键的数目不是1.5NA,错误;C、8.7g二氧化锰的物质的量是0.1mol,HCl的物质的量是0.4mol,恰好符合二者反应的化学方程式中的物质的量之比,但二氧化锰与稀盐酸不反应,所以实际生成的氯气的物质的量小于0.1mol,则氯气的分子数小于0.1NA,错误;D、Na与氧气反应生成过氧化钠时Na失去1个电子生成+1价钠离子,所以1molNa完全反应失去电子数目是NA,错误,答案选A。
考点:考查阿伏伽德罗常数与微粒数的关系
本题难度:困难
5、选择题 Cu、Cu2O和CuO组成的混合物,加入100 mL 0.6mol/LHNO3溶液恰好使混合物溶解,同时收集到224 mLNO气体(标准状况)。下列说法不正确的是
A.产物中硝酸铜的物质的量为0.025 mol
B.若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol
C.若混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量均为0.005 mol
D.混合物中Cu的物质的量的取值范围为0.005mol<n(Cu)<0.015mol
参考答案:B
本题解析:
试题分析:A、100 mL 0.6mol/LHNO3溶液中硝酸的物质的量=0.1L×0.6mol/L=0.06mol。生成NO的物质的量=0.224L÷22.4L/mol=0.01mol,因此根据氮原子守恒可知,硝酸铜的物质的量=(0.06mol-0.01mol)÷2=0.025mol,A正确;B、若混合物中Cu的物质的量为0.005 mol,则根据铜原子守恒可知,Cu2O、CuO中铜原子的物质的量共计是0.025mol-0.005mol=0.02mol,因此Cu2O、CuO的物质的量一定小于0.
本题难度:一般