微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)实验室里迅速制备少量氯气可利用以下反应:
2 KMnO4+16 HCl ="==" 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)该反应中,氧化剂是__________,还原剂是??_________。
(2) 当电子转移的数目为6.02×1023个时生成的氯气的物质的量为??????? mol
mol
(⑶被氧化的还原剂的物质的量是?????? mol
mol
参考答案:(1)? KMnO4?; HCl??? (2)? 0.5??
本题解析:略
本题难度:一般
2、选择题 M2O7X-与S2-在酸性溶液中反应如下:M2O7X-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7X-中M的化合价是
A.+2
B.+3
C.+4
D.+6
参考答案:D
本题解析:略
本题难度:一般
3、选择题 关于反应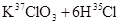

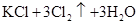 的有关叙述中,正确的是
的有关叙述中,正确的是
A.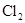 中只含有
中只含有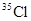
B.KCl中只含有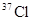
C.生成物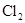 的相对分子质量小于71
的相对分子质量小于71
D.该反应转移电子数为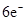
参考答案:C
本题解析:根据反应式可判断,氯酸钾是氧化剂,氯化氢是还原剂。根据电子的得失守恒可知,氧化剂和还原剂的物质的量之比是1︰5,所以氯气既是还原产物,又是氧化产物,二者的物质的量之比是1︰5。即氯气中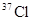 与
与 本题难度:一般
本题难度:一般
4、填空题 已知下列两个反应①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)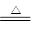 CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
(1)反应①中????????元素被还原,反应②中???????元素被还原.
(2)当反应①生成2gH2时,消耗H2SO4的物质的量是???????????。
(3)反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为????????????,若有4mol H2SO4参加反应时,被还原元素的质量是????????g。
参考答案:(共8分)(1)H 、S(各1分) (2)1mol? (3)
本题解析:
试题分析:(1)反应①中硫酸中氢元素的化合价解得,所以H元素被还原,反应②中硫酸中S元素的化合价降低,所以S元素被还原。
(2)2g氢气的物质的量是1mol,则消耗稀硫酸的物质的量是1mol。
(3)硫酸中S元素的化合价从+6价降低到+4价,得到2个电子,所以反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为2mol。若有4mol H2SO4参加反应时,被还原的硫酸是2mol,所以被还原元素的质量是2mol×32g/mol=64g。
点评:该题是中等难度的试题,试题基
本题难度:一般
5、选择题 在KClO3+6HCl=KCl+3Cl2+3H2O反应中,当生成0.5molCl2时,氧化剂和还原剂的物质的量之比为(?? )
A.6:1
B.1:6
C.1:3
D.1:5
参考答案:D
本题解析:根据反应式可判断,每生成3mol氯气,氧化剂是1mol氯酸钾,还原剂是5mol氯化氢,因此氧化剂和还原剂的物质的量之比为1:5。答案选D。
本题难度:一般