微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3-?对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
①上述反应中的氧化剂为?????????????????????????????????。
②上述反应中若生成标况下3.36LN2,则转移的电子数为?????????????????????????????。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上制取氯气的化学反应方程式为???????????????????????????????????????????????。
②漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,反应的离子方程式为?????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????。
2、填空题 (3分)“5000吨剧毒铬渣污染珠江源头”的报导引起了人们的广泛关注,铬渣中的重铬酸盐污染严重,酸性K2Cr2O7具有较强的氧化性,其还原产物为Cr3+。请写出酸性K2Cr2O7氧化SO2的离子方程式:??????????????????????????????????????????????????????。
3、选择题 已知下列物质都能氧化H2S,它们氧化H2S时自身分别发生下列变化:Fe3+→Fe2+,Cr2O72-→2Cr3+,Br2→2Br-,HNO3→NO。如要氧化等物质的量的H2S气体得到S单质,需要上述离子或物质的物质的量最小的是?????
A.Fe3+
B.Br2
C.Cr2O72—
D.HNO3
4、填空题 氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2)?? ???b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 ???d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。
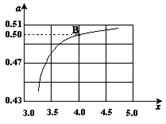
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)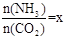 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。
已知:3Cl2+2NH3→N2+6HCl?????――①?? 3Cl2+8NH3→N2+6NH4Cl???――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl2+15NH3→??????????????????????――③
(5)反应③中的还原剂是????????????????,还原产物是??????????????????????。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是????????mol。
5、选择题 氯气与冷的氢氧化钠反应生成NaCl与NaClO,与热的氢氧化钠反应生成NaCl与NaClO3。一定温度下,氯气与氢氧化钠反应生成的NaClO与NaClO3的物质的量之比为2:3,求该反应氧化产物与还原产物的物质的量之比为(????)
A.5/16
B.5/17
C.5/13
D.13/5