微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg=Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显_______________价。
(2)以上反应中的氧化剂为_____________________,当有1 mol CuI参与反应时,转移电子_______________mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式: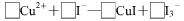
参考答案:
(1)+1
(2)CuI??0.5
(3
本题解析:标注元素的化合价:CuI中Cu为+1,I为-1;Cu2HgI4中I为-1价,Cu 若为+2价,则Hg为0价,Cu若为+1价,Hg为+2价,很明显,Cu取+1价比较合理。
根据化合价变化情况,可以判断出CuI发生了歧化,既是氧化剂,又是还原剂。
本题难度:简单
2、填空题 Ⅰ.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是???????????????????????。?
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
每生成1 mol P4时,就有???mol电子发生转移。?
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2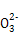 +I2
+I2 S4
S4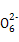 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是???mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I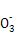 +5S
+5S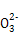 +2H+
+2H+ I2+5S
I2+5S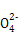 +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
?
| 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL
| 0.01 mol/LNa2SO3溶液的体积/mL
| H2O的体积/mL
| 实验温度/℃
| 溶液出现蓝色时所需时间/s
|
实验1
| 5
| V1
| 35
| 25
| ?
|
实验2
| 5
| 5
| 40
| 25
| ?
|
实验3
| 5
| 5
| V2
| 0
| ?
?
该实验的目的是?????????????????????????????;表中V2=???mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是??????。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O Ce(OH)4↓+?????????????????????????。 Ce(OH)4↓+?????????????????????????。
参考答案:(1) 本题解析:Ⅰ.(1)P的原子序数是15,因此其原子结构示意图为 本题解析:Ⅰ.(1)P的原子序数是15,因此其原子结构示意图为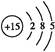 。 。
(2)P元素的化合价由+5价降到了P4中的0价,故每生成1 mol P4转移20 mol电子。
(3)根据化学方程式可知,I2的物质的量等于硫代硫酸钠的物质的量的一半加上维生素C的物质的量,则维生素C的物质的量为:(V1·a×10-3-0.5V
本题难度:一般
3、填空题 某化学兴趣小组用以下装置探究SO2的某些化学性质。
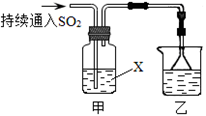
(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
 Ca2++ Ca2++ ClO-+ ClO-+ SO2+ SO2+ H2O= H2O= ↓+ ↓+ Cl-+ Cl-+ SO42-+ SO42-+ 。 。
参考答案:(1)尾气处理(2分)
(2)c(2分)
本题解析:
试题分析:(1)1体积水中能溶解40体积的二氧化硫,所以用水可吸收二氧化硫,进行尾气处理。
(2)能使品红溶液褪色,说明SO2具有漂白性;若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,SO2与S2?反应生成了S,体现了SO2的氧化性。
(3)ClO?中Cl元素化合价降低,则SO2中S元素化合价升高,生成的沉淀为CaSO4,同时生成H+,配平可得离子方程式:Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+ SO42-+4H+
考点:本题考查实验装置的用途、实验现象的分析、离子方程式的配平与书写。
本题难度:一般
4、选择题 已知镁和稀硝酸反应时,参加反应的镁和稀硝酸的物质的量之比为2:5 ,此时硝酸的还原产物可能是(?????)
A.NO2
B.N2O
C.N2O3
D.NO
参考答案:B
本题解析:设反应的镁和稀硝酸分别为2mol和5mol,稀硝酸在反应中既表现氧化性又表现酸性生成硝酸镁,表现酸性的硝酸为4mol,则表现氧化性的为1mol。根据电子守恒,镁失去4mol电子,则1mol硝酸被还原得4mol电子,所以+5价的氮元素化合价应降低4价,生成+1价,故选B
本题难度:简单
5、填空题 铁能在稀硝酸中溶解:
 →Fe(NO3)3+NO↑+2H2O →Fe(NO3)3+NO↑+2H2O
24.在上述方程式上标出电子转移的方向和数目。
25.该反应中被还原的元素是???????,还原剂是?????????。
26.若有0.1 mol铁参加反应,被还原的HNO3为???????mol。
参考答案:24.略,(2分,方向和数目各1分)。
25.+5价的
本题解析:
试题分析:24.在方程式中Fe→Fe3+,失去3e-,故 。 。
25.反应中化合价降低的元素是被还原,为+5价N,失去电子的物质是还原剂,是Fe。
26.反应中被还原的HNO3生成NO,故有0.1 mol铁参加反应,被还原的HNO3为0.1mol。
本题难度:一般
|