微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)请根据所学化学知识回答下列问题:
(1)氯化铁溶液蒸干并灼烧后得到的固体物质的化学式是________。
(2)在浓度均为0.1 mol/L的①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4四种溶液中,NH4+浓度由大到小的顺序为________(用代号表示)。
(3)25时,某浓度的CH3COONa溶液呈碱性的原因是________(用离子方程式表示),溶液中所有离子的浓度由大到小的顺序是________。
(4)某温度下,蒸馏水的pH = 6,氢氧化物R(OH)2的Ksp = 1×10-13,则R2+沉淀完全时,溶液的pH为_______。
参考答案:(1) Fe2O3 (2
本题解析:
试题分析:(1)加入氯化铁溶液,会促进水解,HCl不断挥发,导致最终得到Fe(OH)3,灼烧后得Fe2O3 ,(2)比较离子的浓度大小,分析物质的组成,且盐类的水解程度微弱,所以NH4+的离子浓度最大的是④,①中发生双水解,离子浓度最小,②中H+抑制水解,③电离程度小,所以离子浓度最小。(4)由已知条件确定该温度下水的离子积为10-12,当则R2+沉淀完全时,离子浓度小于10-5,结合物R(OH)2的Ksp = 1×10-13,c(OH-)=10-4mol/L,c(H+)=Kw/c(OH-)=10-8mol/L,所以pH为8.
考点:盐类的水解、离子浓度的大小比较、溶度积的计算。
本题难度:一般
2、选择题 设NA为阿伏伽德罗常数的值。下列说法正确的是
A.200 mL1 mol Al2(SO4)3溶液中,Al3+和SO42—离子数的总和为NA
B.标准状况下,2.24 L乙醇中含有的C—H键数目为0.5NA
C.0.1 mol Na完全被氧化生成Na2O2,转移电子的数目为0.1NA
D.0.1 mol O2和O3的混合气体中含氧原子数目为0.2NA
参考答案:C
本题解析:
试题分析:A.硫酸铝是强酸弱碱盐,Al3+水解导致Al3+和SO42—离子数的总和小于NA,A项错误;B.在标准状况下,乙醇是液体,无法计算物质的量,B项错误;C.Na是活泼金属,在化学反应中失去1个电子,所以0.1 mol Na完全被氧化生成Na2O2,转移电子的数目为0.1NA,C项正确;D.氧气是双原子分子,臭氧是3原子分子,所以0.1mol分子中含有的氧原子数无法计算,D项错误;选C。
考点:考查阿伏伽德罗常数及计算。
本题难度:一般
3、选择题 等体积等物质的量浓度MOH强碱和HA弱酸溶液混合后,混合液中有关离子浓度应满足的关系 是
A.c(M+)>c(H+)>c(A-)>c(OH-)
B.c(M+)>c(A-)>c(OH-)>c(H+)
C.c(M+)>c(OH-)>c(A-)>c(H+)
D.c(M+)>c(A-)>c(H+)>c(OH-)
参考答案:B
本题解析:
试题分析:等体积等物质的量浓度MOH强碱和HA弱酸溶液混合后,生成的MA盐是强碱弱酸盐,A-水解显碱性,离子浓度关系为c(M+)>c(A-)>c(OH-)>c(H+) ,选B。
考点:盐类水解和溶液中离子浓度的大小
本题难度:困难
4、选择题 FeCl3水解平衡为:Fe3++3H2O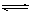 Fe(OH)3+3H+;若要使c(Fe3+)降低,且pH值增大的方法是
Fe(OH)3+3H+;若要使c(Fe3+)降低,且pH值增大的方法是
A.降低温度
B.通入少量HCl气体
C.加入少量Fe粉
D.加入适量蒸馏水
参考答案:CD
本题解析:
试题分析:降低温度,平衡左移,c(Fe3+)增大,故A错误;通入少量HCl气体,pH值减小,故B错误;加入少量Fe粉,发生反应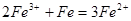 ,c(Fe3+)降低,水解平衡左移,pH值增大,故C正确;加入适量蒸馏水,c(Fe3+)、c(H+)都减小,故D正确。
,c(Fe3+)降低,水解平衡左移,pH值增大,故C正确;加入适量蒸馏水,c(Fe3+)、c(H+)都减小,故D正确。
考点:本题考查盐的水解。
本题难度:一般
5、填空题 直接排放含SO2,的烟气会形成胶雨,危害环境。利用钠碱循环法可脱除烟气中的SO2
(1)在钠碱循环法中,Na2 SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,
该反应的离子方程式是
(2)吸收液吸收SO2的过程中,pH随n(SO3²-):n(HSO3
参考答案:
本题解析:
本题难度:困难