微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各电离方程式中,错误的是
A.NaOH=Na++O2-+H+
B.Na2SO4=2Na++SO42-
C.HNO3=H++NO3-
D.MgCl2=Mg2++2Cl-
参考答案:A
本题解析:分析:先判断电解质的强弱,强电解质用“═”,电离方程式应遵循质量守恒定律和电荷守恒,并注意原子团不可拆分来解答.
解答:A、NaOH为强电解质,电离方程式为NaOH=Na++OH-,故A错误;
B、Na2SO4为强电解质,电离方程式为Na2SO4=2Na++SO42-,遵循质量守恒定律和电荷守恒,故B正确;
C、HNO3为强电解质,电离方程式为HNO3=H++NO3-,遵循质量守恒定律和电荷守恒,故C正确;
D、MgCl2为强电解质,电离方程式为MgCl2=Mg2++2Cl-,遵循质量守恒定律和电荷守恒,故D正确;
故选A.
点评:本题考查电离方程式的书写,明确电解质的强弱、物质中的原子团及电离方程式的书写方法即可解答,难度不大.
本题难度:一般
2、填空题 按要求完成下列化学反应式
(1)硫酸氢钠在水溶液中的电离方程式 ;
(2)Na2CO3溶液水解的离子方程式 ;
(3)Al2(SO4)3溶液与NaHCO3溶液混合反应的离子方程式 ;
(4)Mg3N2与水反应的化学方程式 ;
参考答案:(1) NaHSO4 = &
本题解析:
试题分析:(1)硫酸氢钠为强酸酸式盐,电离产生Na+、H+、SO42?,可得电离方程式。
(2)CO32?分步水解:CO32-+H2O HCO3-+OH-;HCO3-+H2O
HCO3-+OH-;HCO3-+H2O H2CO3+OH-。
H2CO3+OH-。
(3)Al3+与HCO3?发生相互促进的水解反应:Al3++3HCO3-=Al(OH)3↓+3CO2 ↑。
(4)氮化镁与水反应生成氢氧化镁和氨气:Mg3N2+6H2O=3Mg(OH)2+2NH3↑。
考点:本题考查
本题难度:一般
3、简答题 (20分)硝酸铝是重要的化工原料。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有 。
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为 。
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式 。
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。

①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。

②经搅拌Ⅱ,pH下降的原因是 。
③凝胶中含有的硝酸盐是 。
(Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化: 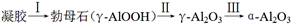 。
。
煅烧过程中样品的失重率(TG%)随温度变化如图。凝胶煅烧失重曲线有明显的三个阶段:

(i)a~b段:失重率82.12%;
(ii)b~c段:失重率9.37%;
(iii)c~d段:失重率几乎为0;
转化Ⅱ对应的失重阶段是 (填序号),转化Ⅲ开始的温度是 。
参考答案:(20分)
(1)B(2分)
(2)2Al+6H
本题解析:
试题分析:(1)硝酸铝中氮元素的化合价为+5,处于最高价,所以硝酸铝具有氧化性,在实验室中,硝酸铝必须与可燃物分开存放,故B项正确。
(2)Al作电极电解HNO3溶液制取Al(NO3)3,阳极上Al失电子生成Al3+,阴极上H+得电子生成H2,所以电解反应的离子方程式为:2Al+6H+ 2Al3++3H2↑。
2Al3++3H2↑。
(3)[Al(OH)]2+结合H2O中的羟基可转化为[Al(OH)2]+,所以离子方程式为:[Al(OH)]2++H2O [Al(OH)2]++H+。
[Al(OH)2]++H+。
(4)①根据元素守恒和电荷守恒,可知所缺离子为阳离子且含有N元素,为NH4+,根据观察法可配平该离子方程式。
②溶液中含有Al3+,经搅拌Ⅱ,Al3+的水解程度增大,所以pH下降。
③加入(CH2)6N4后生成NH4+,所以溶液中含有NH4NO3,根据pH=3.95可得c(OH?)=10-14÷10-3.95=10-10.05,则c(Al3+)=Ksp[Al(OH)3]÷c(OH?)3=1.3×10-33÷(10-10.05)3=1.3×10-2.85mol?L?1>1×10-5 mol·L-1,所以溶液还含有Al(NO3)3。
④转化II由γ-AlOOH转化为γ-Al2O3,失重率=18÷120×100%=12%,根据图像可知对应的失重阶段是i;转化III有γ-Al2O3转化为α-Al2O3,根据图像可知对应的失重阶段是iii,开始温度是600℃。
考点:本题考查物质的性质及应用、电解原理、方程式的配平及书写、化学流程及图像的分析。
本题难度:困难
4、填空题 (14分)碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g)
2Fe(s) + 3CO(g) +6H2(g)
参考答案:
本题解析:
本题难度:困难
5、填空题 硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
第1组
| 第2组
| 第3组
|
S (单质)
| SO2、H2SO3、M、NaHSO3
| SO3、H2SO4、Na2SO4、NaHSO4
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。
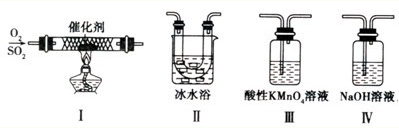
(1)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
n(SO32—):n(HSO3—)
| 91:9
| 1:1
| 9:91
| pH
| 8.2
| 7.2
| 6.2
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是 。
A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—)
B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+)
C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+)
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
序号
| 实验方案
| 实验现象
| 结论
| 方案①
| 往第一份试液中加入KMnO4溶液溶液
| 紫红色褪去
| SO2与Fe3+反应生成了Fe2+
| 方案②
| 往第二份试液中加入
|
| SO2与Fe3+反应生成了Fe2+
| 方案③
| 往第二份试液中加入
|
| SO2与Fe3+反应生成了SO42—
上述方案①得出的结论是否合理 ,原因 。
如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。
(4)装置B中能表明Br—的还原性弱于SO2的现象是 。
参考答案:I,Na2SO3 Ⅱ,(1)B、D (2
本题解析:
试题分析:I.四者对应的关系为:氧化物,氧化物对应的水化物,正盐,酸式盐,故答案为Na2SO3。
Ⅱ.(1)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错;B、浓硫酸虽
具有强氧化性,但不能氧化亚硫酸钠,故B正确;C、固体硫在纯氧中燃烧,操作不容易控制,故C
错;D、Cu+2H2SO4( 浓 ) CuSO4+SO2↑+2H2O,故D正确。 CuSO4+SO2↑+2H2O,故D正确。
(2)吸收液中n(SO32-):n(HSO3-)=10:1 时,依据图表数据分析判断,溶液呈碱性,亚硫酸钠物
质的量大于亚硫酸氢钠A、依据溶液中电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-);
故A正确;B、溶液中亚硫酸钠多溶液呈碱性,亚硫酸根离子大于亚硫酸氢根离子,钠离子浓度最大,
离子浓度大小为:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+);故B错误;C、溶液中亚硫酸钠多溶液呈碱性,亚硫酸根离子大于亚硫酸氢根离子,钠离子浓度最大,离子浓度大小为:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+),故C正确。
(3)不合理,因为 SO2、Fe2+都能使酸性高锰酸钾溶液褪色; 方案②:往第二份试液中加入KSCN溶液,观察现象,再加入新制的氯水,先不变红,后变红。方案③:往第二份试液中加入稀盐酸酸化,再加入氯化钡溶液产生白色沉淀。(4)溴被还原,故B中橙色(或黄色)褪去。
考点:性质实验方案的设计;离子浓度大小的比较;氧化还原反应。
本题难度:困难
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772