微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示。
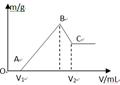
(1)写出BC过程的离子反应方程式
(2)当V1=140mL时,混合物中n(Mg)=_____mol,V2=_____mL
(3)滴入的NaOH溶液_____mL时,溶液中的Mg2+和Al3+刚好沉淀完全。
(4)若混合物中Mg的物质的量分数为a,当滴入的NaOH溶液为450mL时,所得沉淀中无Al(OH)3,则a的取值范围是____________________
(5)当加入V2 mlNaOH溶液后过滤,向滤液中通入过量的CO2气体,能观察到的现象为 ,写出该过程反应的离子方程式 。
参考答案:(1)Al(OH)3 + OH- ==AlO2-
本题解析:
试题分析:(1)由图可以知道,刚开始为酸碱中和,从V1开始,边有沉淀生成,而由于氢氧化铝为两性物质,故BC过程的离子反应方程式为:Al(OH)3 + OH- ==AlO2- +2H2O;(2)当V1=140mL时,则与镁铝反应的盐酸的量n=0.1×4-0.14×1=0.26mol,设镁为amol,铝为bmol,即a+b=0.1,2a+3b=0.26,联立解得a=0.04,b=0.06,所以混合物中n(Mg)=0.04mol,即从V1到V2所需要的氢氧化钠的物质的量n=0.04×2+0.06×4=0.32,故需要氢氧化钠的体积为0.32/1=0.32L=320mL,所以V2=140+320=460mL;溶液中的Mg2+和Al3+刚好沉淀完全,为图中的b点,故需要氢氧化钠的量n=0.04×2+0.06×3=0.26,故需要氢氧化钠的体积为0.26/1=0.26L=260mL,所以V2=140+260=400mL,故滴入的NaOH溶液为100mL时,溶液中的Mg2+和Al3+刚好沉淀完全;(4)0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,100mL4mol/L的盐酸中氢离子的物质的量为0.4mol,而Mg、Al转化为离子,而450mLNaOH溶液中氢氧根的物质的量为0.45mol,故只能有0.45-0.4=0.05mol的氢氧根来溶解氢氧化铝,根据
Al(OH)3 + OH- ==AlO2- +2H2O可以知道,Al(OH)3的物质的量不能超过0.05mol,所以即a要大于等于0.05/0.1=0.5,而有不能大于0.1/0.1=1,即a的取值范围为: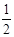 ≤a<1;(5) 当加入V2 mlNaOH溶液后过滤,向滤液中通入过量的CO2气体,则产生了氢氧化铝沉淀,故能观察到的现象为产生了白色胶状沉淀,该离子方程式为:AlO2- + CO2 + 2H2O ==Al(OH)3↓+HCO3-。
≤a<1;(5) 当加入V2 mlNaOH溶液后过滤,向滤液中通入过量的CO2气体,则产生了氢氧化铝沉淀,故能观察到的现象为产生了白色胶状沉淀,该离子方程式为:AlO2- + CO2 + 2H2O ==Al(OH)3↓+HCO3-。
考点:铝及其化合物
点评:本题考查了铝及其化合物的相关计算,该题要求学生具有较强的数学分析能力,该题难度较大。
本题难度:一般
2、选择题 同体积、同物质的量浓度的BaCl2溶液可使同体积的Fe2(SO4)3、ZnSO4、K2SO4三种溶液中的SO42—完全沉淀,则三种硫酸盐中金属离子物质的量浓度之比为
A.1∶2∶3
B.2∶3∶6
C.1∶3∶6
D.6∶2∶1
参考答案:B
本题解析:
试题分析:设三种硫酸盐中金属离子物质的量浓度分别是a、b、c,则根据Ba2++SO42-=BaSO4↓可知,3a=b=c,解得a∶b∶c=2∶3∶6,答案选B。
考点:考查物质的量浓度的有关计算
点评:该题的关键是根据物质化学式找出该物质与所含SO42-的个数之比,然后带入关系式计算即可。
本题难度:一般
3、选择题 下列物质中,含有0.4 mol氯离子的是( )。
A.0.4 mol KClO3
B.4/30 mol FeCl3
C.3/40 mol FeCl3
D.0.1 mol KCl
参考答案:B
本题解析:KClO3是由钾离子与氯酸根离子形成的离子化合物,其中不含氯离子。
本题难度:简单
4、填空题 (8分)同温同压下,同体积的氨气和硫化氢(H2S)气体的质量比为______________;同质量的氨气和硫化氢(H2S)气体的体积比为__________________,所含原子个数比为
_____________;若两者所含氢原子数相等,它们的物质的量比是__________________。
参考答案:1:2?? 2:1?? 8:3?? 2:3
本题解析:略
本题难度:简单
5、选择题 将10g由Mg、Zn、Fe组成的混合物与40mL稀硫酸恰好完全反应,产生的氢气在标准状况下为5.6L,则三种金属的物质的量之和为?????????????(???)
A.0.5mol
B.0.25mol
C.0.1mol
D.0.125mol
参考答案:B
本题解析:
试题分析:Mg、Zn、Fe反应后均为二价即1mol(任何一种金属也可以是混合物)可置换出氢气1mol,5.6L标况氢气为5.6/22.4mol=0.25mol??则三种金属的物质的量之和为0.25mol。
点评:掌握相关金属与酸反应的计算技巧可快速解决此类问题。
本题难度:一般