微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法错误的是( )
A.强电解质在水溶液中的电离过程是不可逆的
B.铅蓄电池中,电解质溶液是硫酸溶液
C.CuSO4溶液蒸干灼烧得到CuO固体
D.在原电池的负极和电解池的阳极上都是发生失电子的氧化反应
参考答案:A.完全电离的电解质是强电解质,所以在水溶液里强电解质电离过
本题解析:
本题难度:一般
2、选择题 在相同温度时,100mL0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值中,前者大于后者的是
[???? ]
A.H+的物质的量
B.醋酸的电离常数
C.中和时所需NaOH的量
D.CH3COOH的物质的量
参考答案:A
本题解析:
本题难度:一般
3、选择题 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如下图所示。据图判断正确的是
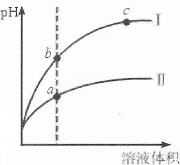
A.Ⅱ为盐酸稀释时的pH变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
参考答案:B
本题解析:
试题分析:A、HCl完全电离,CH3COOH部分电离,稀释能促进CH3COOH电离,前者的c(H+)明显减小,pH明显增大,则I为盐酸,错误;B、pH:b<c,则c(H+):b>c,正确;C、Kw只与温度有关,与溶液的酸性强弱无关,错误;D、pH:b>a,则c(H+):b<a,由于电离程度:HCl>CH3COOH,则浓度:HCl<CH3COOH,错误。
本题难度:一般
4、选择题 下列关于强、弱电解质的叙述中正确的是( )
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.强电解质熔化时都完全电离,弱电解质在水溶液中部分电离
D.强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱
参考答案:D
本题解析:强极性的共价化合物也是强电解质,A错误;强、弱电解质与溶解性无关,B错误;溶于水或熔化时完全电离的电解质是强电解质,C错误;电解质导电是有条件的,溶液的导电性与溶液中离子所带的电荷浓度有关,D正确。
本题难度:一般
5、填空题 今有浓度均为0.1mol/L的醋酸、盐酸和硫酸三种稀溶液,按下列题示回答问题(回答时用“>”、“<”或“=”连接a、b、c):
(1)设三种溶液的pH分别为a、b、c,则大小关系为 。
(2)若取等质量的锌分别跟这三种溶液反应,使锌恰好完全反应时,所消耗三种酸的体积分别为a、b、c,则其大小关系为 。
(3)取上述三种溶液各10mL,分别跟0.1mol/LNaOH溶液10mL混合,当反应结束后,三种混合液的pH分别为a、b、c ,则其大小关系为 。
参考答案:(1)a>b>c(2)a=b>c(3)a>b>c
本题解析:
试题分析:(1)醋酸是一元弱酸。在溶液中存在电离平衡:CH3COOH CH3COO-+H+。c(CH3COOH)>c(H+),盐酸和硫酸都是强酸,完全电离,盐酸是一元强酸,硫酸是二元强酸,电离方程式为: HCl=H++Cl-.H2SO4=2H++SO42-。所以c(H+)硫酸>盐酸>醋酸。c(H+)越大,溶液的pH越小。故设三种溶液的pH分别为a、b、c,则大小关系为a>b>c 。(2)(2)若取等质量的锌分别跟这三种溶液反应,使锌恰好完全反应时,所消耗三种酸的体积分别为a、b、c,假设Zn的物质的量为1mol,则消耗的三种酸的物质的量为2mol、2mol、1mol.由于三种酸的物质的量浓度相等,所以消耗的三者的体积大小关系为a=b=2c(或a=b>c)。(3)取上述三种溶液各10mL,分别跟0.1mol/LNaOH溶液10mL混合,当反应结束后,得到的物质分别NaAc、NaCl、NaHSO4。NaAc是强碱弱酸盐,水解使溶液显碱性;NaCl是强酸强碱盐,不水解,溶液显中性;NaHSO4是强酸的酸式盐,电离产生H+使溶液显酸性。若三种混合液的pH分别为a、b、c ,则其大小关系为a>b>c。
CH3COO-+H+。c(CH3COOH)>c(H+),盐酸和硫酸都是强酸,完全电离,盐酸是一元强酸,硫酸是二元强酸,电离方程式为: HCl=H++Cl-.H2SO4=2H++SO42-。所以c(H+)硫酸>盐酸>醋酸。c(H+)越大,溶液的pH越小。故设三种溶液的pH分别为a、b、c,则大小关系为a>b>c 。(2)(2)若取等质量的锌分别跟这三种溶液反应,使锌恰好完全反应时,所消耗三种酸的体积分别为a、b、c,假设Zn的物质的量为1mol,则消耗的三种酸的物质的量为2mol、2mol、1mol.由于三种酸的物质的量浓度相等,所以消耗的三者的体积大小关系为a=b=2c(或a=b>c)。(3)取上述三种溶液各10mL,分别跟0.1mol/LNaOH溶液10mL混合,当反应结束后,得到的物质分别NaAc、NaCl、NaHSO4。NaAc是强碱弱酸盐,水解使溶液显碱性;NaCl是强酸强碱盐,不水解,溶液显中性;NaHSO4是强酸的酸式盐,电离产生H+使溶液显酸性。若三种混合液的pH分别为a、b、c ,则其大小关系为a>b>c。
考点:考查等浓度的醋酸、盐酸和硫酸三种稀溶液的pH、与Zn、NaOH等发生反应时溶液的体积及pH的关系的知识。
本题难度:一般