微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是(???)
A.PCl3分子中三个共价键的键长、键角都相等
B.PCl3分子中的P-Cl键属于极性共价键
C.PCl3分子中三个共价键键能、键角均相等
D.PCl3是非极性分子
参考答案:D
本题解析:
试题分析:三氯化磷分子中中心原子P原子含有的孤对电子对数是(5-3×1)÷2=1,所以该化合物是三角锥形结构,属于极性分子,答案选D。
点评:该题是中等难度的试题,也是高考中的常见考点。本题主要是考查学生对价层电子对互斥理论的熟悉了解程度,意在培养学生的逻辑推理能力和空间想象能力,提高学生的应试能力。
本题难度:简单
2、填空题 (10分)元素周期表中第三周期元素的单质及其化合物的用途广泛。
(1)该周期元素中,半径最小的简单离子的离子结构示意图为 。
(2)能证明氯的非金属性(得电子能力)比硫强的化学方程式为 。
(3)NaHSO3溶液呈酸性,其溶液中离子浓度由大到小的顺序为 。
(4)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,该反应的离子方程式为 。
(5)已知下列两反应过程中能量变化如图所示:
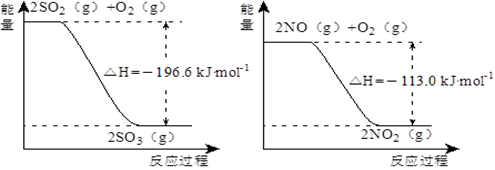
汽车尾气中含有的少量NO2和SO2在一定条件下会发生反应,该反应的热化学方程式为____________。
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)在第三周期元素中,半径最小的简单离子是铝离子,其离子结构示意图为 。
。
(2)非金属性强元素单质能置换出非金属性弱的单质,则能证明氯的非金属性(得电子能力)比硫强的化学方程式为Cl2 + H2S = S↓ + 2HCl。
(3)NaHSO3溶液中电离程度大于水解程度,因此溶液呈酸性,所以其溶液中离子浓度由大到小的顺序为[Na+]>[HSO3-]>[H+]>[ SO32-]>[OH-]。
(4)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,则根据电子得失守恒以及质量守恒定律可知该反应的离子方程式为2 ClO2 + 5Mn2+ + 6H2O = 5MnO2 ↓+ 2Cl- + 12H+。
(5)根据图像可知反应的热化学方程式为① O2(g) +2SO2(g) =2SO3(g) △ H =-196.6kJ·mol-1、②2NO(g) + O2(g) =2NO2(g) △ H = -113.kJ·mol-1,则根据盖斯定律可知(①-②)÷2即得到NO2(g) + SO2(g) =" NO(g)" + SO3(g) △ H = -41.8kJ·mol-1。
考点:考查元素周期律的应用以及热化学方程式书写等
本题难度:一般
3、选择题 下列离子方程式书写正确的是
A.碳酸钠水解:CO32-+2H2O?H2CO3+2OH-
B.次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O=2HClO+SO32-
C.用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑
D.向Mg(OH)2悬浊液中加入FeCl3溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
参考答案:D
本题解析:分析:A.多元弱酸根离子水解分步进行,以第一步为主;
B.发生氧化还原反应生成硫酸钠和盐酸;
C.醋酸应保留化学式;
D.氢氧化铁的溶解度比氢氧化镁的溶解度小.
解答:A.碳酸钠水解的离子反应为CO32-+H2O?HCO3-+OH-,故A错误;
B.次氯酸钠溶液中通入二氧化硫气体的离子反应为ClO-+SO2+H2O=2H++Cl-+SO42-,故B错误;
C.用醋酸除去水垢的离子反应为CaCO3+2HAc=Ca2++H2O+CO2↑+2Ac-,故C错误;
D.向Mg(OH)2悬浊液中加入FeCl3溶液的离子反应为3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+,故D正确;
故选D.
点评:本题考查离子反应方程式的书写,涉及水解、氧化还原反应、复分解反应及沉淀转化,综合性较强,题目难度中等.
本题难度:简单
4、填空题 有下列几种物质:①Ne、②NH4Cl、③NaOH、④Cl2、⑤CO2、⑥H2O、⑦Na2O2。
(1)上述物质中,属于共价化合物的是????????????(填序号,下同),既存在离子键又存在极性键的是??????????。
(2)②号物质的电子式为??????????、用电子式表示⑥号物质的形成过程:???????????。
参考答案:(10分)(1)⑤⑥;②③
(2) 本题解析:
本题解析:
试题分析:(1)全部由共价键形成的化合物是共价化合物,所以属于共价化合物的是CO2和H2O,答案选⑤⑥;一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。如果是同一种非金属形成的共价键则是非极性键,如果是不同种非金属形成的共价键,则是极性键,所以既存在离子键又存在极性键的是氯化铵和氢氧化钠,答案选②③。
(2)氯化铵是离子化合物,电子式是 本题难度:一般
本题难度:一般
5、选择题 已知:①H2(g)+1/2O2(g)===H2O(g) △H1 ="=" a kJ.mol-1
②2H2(g)+ O2(g)===2H2O(g) △H2 ="=" b kJ.mol-1
③H2(g)+1/2O2(g)===H2O(l) △H3 ="=" c kJ.mol-1
④2H2(g)+ O2(g)===2H2O(l) △H4 ="=" d kJ.mol-1
下列关系式中正确的是
A.a
参考答案:
本题解析:
本题难度:一般